
Chemiker entwickeln neues Verfahren zur selektiven Bindung von Proteinen
Eine neue Methode, um Proteine selektiv an Nanopartikel zu binden, beschreibt ein deutsch-chinesisches Forscherteam um Chemiker Prof. Dr. Bart Jan Ravoo vom „Center for Soft Nanoscience“ der Westfälischen Wilhelms-Universität Münster (WWU). Die Nanopartikel erkennen automatisch spezielle Peptide, also sehr kleine Proteine, und gehen jeweils eine hoch selektive Bindung mit ihnen ein. Unter den Peptiden, die die Wissenschaftler exemplarisch untersuchten, waren auch Amyloide. Ablagerungen von Amyloiden spielen beispielsweise bei der Alzheimer-Erkrankung eine zentrale Rolle. Die Wissenschafter hoffen daher, dass der von ihnen entdeckte Mechanismus einen neuen Ansatz zur Behandlung von Erkrankungen liefern könnte, bei denen derartige Ablagerungen auftreten. Die Studie ist aktuell in der Fachzeitschrift „Nature Chemistry“ veröffentlicht.
Erzeugung passgenauer Kontaktoberflächen
Die Wechselwirkung zwischen Proteinmolekülen untereinander oder auch mit anderen Biomolekülen spielt eine zentrale Rolle in sehr vielen physiologischen Prozessen. Die molekulare Erkennung umfasst dabei die Bindung von Proteinen durch Kontaktpunkte im Nanomaßstab auf der Proteinoberfläche. Typischerweise sind sehr viele dieser Punkte involviert, sodass eine einzigartige, passgenaue und komplementäre Kontaktoberfläche entsteht. Der Mechanismus der Bindung der Proteinmoleküle wird daher als „Schlüssel-Schloss-Prinzip“ bezeichnet. Die Wissenschaftler beschreiben nun eine Methode, um solche Kontaktoberflächen auf Nanopartikeln zu erzeugen, sodass gezielt ausgewählte Proteine gebunden werden können.
Selbstorganisation und „Heteromultivalenz“
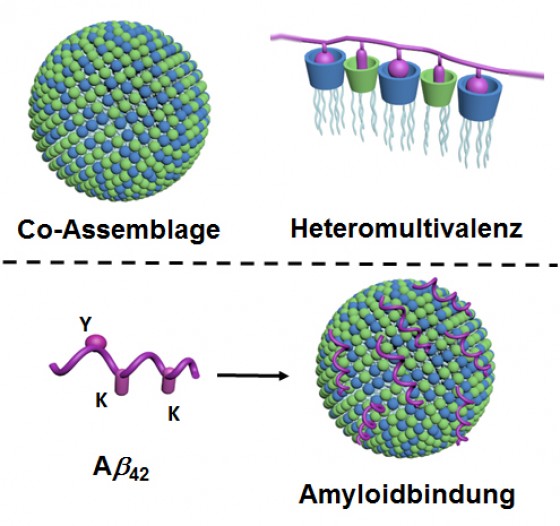
Potenzial für Diagnostik, Bildgebung und Wirkstoffe
„Insbesondere dieses Prinzip der Heteromultivalenz wurde bisher noch kaum im Detail untersucht oder ausgenutzt“, sagt Bart Jan Ravoo. „Wir beschreiben eine völlig neue Herangehensweise, die es ermöglichen wird, weitere künstliche Proteinbinder zu entwickeln. Diese könnten beispielsweise für die Diagnostik oder für die Bildgebung eingesetzt werden oder auch als potenzielle Wirkstoffe infrage kommen.“ Das Forscherteam zeigte, dass die Nanopartikel Bindungen mit Amyloiden eingehen und dadurch Aggregate dieser Peptide auflösen. Das Auftreten von Amyloid-Aggregaten hängt eng mit der Entstehung von Alzheimer zusammen. Daher könnte die neue Methode ein Ansatz zur Entwicklung von neuen Behandlungsmethoden liefern. Allerdings ist nicht geklärt, ob die Amyloid-Aggregate Alzheimer tatsächlich verursachen oder vielmehr eine Folge der Erkrankung sind. Die neue Methode zum Auflösen der Aggregate wurde bislang zudem nur im Reagenzglas getestet. Es sind also weitere Studien nötig, um ihr Potenzial als Behandlungsansatz sicher beurteilen zu können.
Zur Methode
Als selbstorganisierende Bausteine für die Nano-Kontaktpunkte setzten die Wissenschaftler amphiphile, wasserlösliche Cyclodextrin- und Calixaren-Moleküle ein. Sie untersuchten die Bindung der entstandenen Nanopartikel an die Peptide unter anderem per Fluoreszenzspektroskopie. Die Bindung an die Amyloide wiesen sie mit Elektronenmikroskopie nach.
Förderer
Die Arbeit wurde gefördert von der Deutschen Forschungsgemeinschaft im Rahmen des Sonderforschungsbereichs (SFB) 858 „Synergistische Effekte in der Chemie – Von der Additivität zur Kooperativität“ sowie von der „National Natural Science Foundation of China“.
Originalveröffentlichung
Zhe Xu, Shao-Rui Jia, Wei Wang, Zhi Yuan, Bart Jan Ravoo and Dong-Sheng Guo, Heteromultivalent Peptide Recognition by Co-Assembly of Cyclodextrin and Calixarene Amphiphiles Enables Inhibition of Amyloid Fibrillation, Nature Chemistry 2018, in press. DOI 10.1038/s41557-018-0164-y
