Mikrobielle Polyester
Schlüsselenzyme: PHA Synthase
 |
|
Abb. 1 |
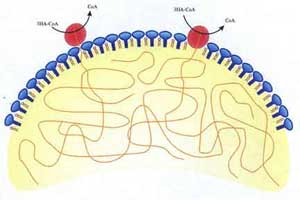
Das Substrat (R)-3-Hydroxylacyl-Coenzyme A wird zum Polyester bei gleichzeitiger Freisetzung von Coenzym A, polymerisiert. Dabei erfolgt eine kovalente Acylierung des konservierten Cysteinrestes der PHA-Synthase. Als möglicher Reaktionsmechanismus wird der Reaktionsmechanismus der Lipasen postuliert. Neben dem an der kovalenten Katalyse beteiligten, konservierten Cysteinrest wurden ebenso analog zu den Lipasen zwei weitere konservierte Reste, Aspartat und Histidin, gefunden, die essentiell für die PHA-Synthaseaktivität sind. Diese sogenannte katalytische Triade befindet sich in der "Core"-Struktur des Lipase-basierten topologischen Protein-Modells der PHA-Synthasen. Im Arbeitskreis werden Untersuchungen zur Identifizierung neuer PHA-Synthasen und zum Verständnis der Enzymologie durchgeführt.
|
Tab. 1 PHA-Synthasen werden in vier Klassen unterteilt. |
 |
Anabolismus von PHAs
Aktivierte Vorstufen für die PHA-Biosynthese können grundsätzlich von dem zentralen Metaboliten Acetyl-CoA oder von Intermediaten der primären Stoffwechselwege Citrat-Zyklus, Fettsäure-ß-Oxidation und Fettsäure-de novo-Biosynthese sowie dem Stoffwechsel von Aminosäuren abgeleitet werden.
 |
|
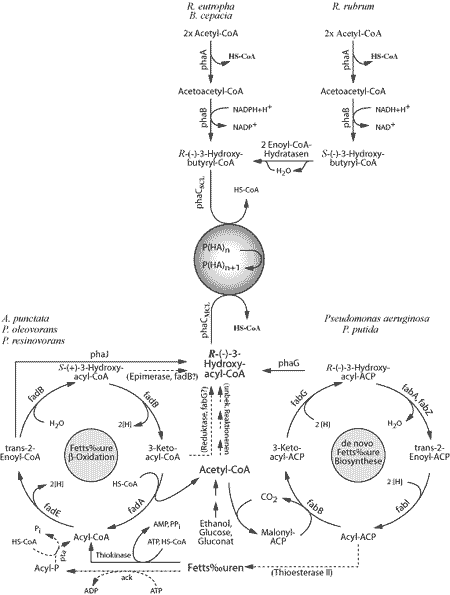
Abb. 2 Bereitstellung der PHA-Monomere in Ralstonia eutropha, Rhodospirillum rubrum, Aeromonas punctata und verschiedenen Pseudomonaden. |
Ausgehend vom Acetyl-CoA wird mit Hilfe der PHA-Biosyntheseenzyme ß-Ketothiolase und Acetoacetyl-CoA-Reduktase (R)-3-Hydroxybutyryl-CoA gebildet, welches die direkte Vorstufe der Poly(3-Hydroxybuttersäure) darstellt. Dienen Fettsäuren als Kohlenstoffquelle so werden über die Fettsäure-ß-Oxidation in geringem Umfang Intermediate ((R)-3-Hydroxyacyl-CoA) bereitgestellt, die direkt als aktivierte Vorstufen für die PHA-Biosynthese dienen. In Pseudomonaden und Aeromonas caviae wurden PHA-biosynthetische (R)-spezifische Enoyl-CoA Hydratasen (PhaJ) identifiziert, die die enantioseleektive Umwandlung des (S)-3-Hydroxyacyl-CoA (Intermediat der Fettsäure-ß-Oxidation) in das (R)-Enantiomer katalysieren, welches direkt als aktivierte Vorstufe der PHA-Biosynthese dient. Pseudomonaden sind ebenso in der Lage ausgehend von einfachen Kohlenstoffquellen, wie z.B. Gluconat, PHAs zu synthetisieren, deren Bausteine Kettenlängen von 6-14 Kohlenstoffatomen umfassen. Hier werden Intermediate (Acyl Carrier Protein Thioester) der Fettsäure-de novo-Biosynthese durch das PHA-biosynthetische Enzym PhaG (Transacylase) in die korrespondierenden Coenzym A Thioester überführt. PhaG wurde bisher nur in Pseudomonaden gefunden und katalysiert die metabole Verknüpfung zwischen Fettsäure-de novo-Biosynthese und PHA-Synthese. Im Arbeitskreis wurde erstmals die rekombinante Biosynthese von PHAs, bestehend aus nur 4-Hydroxybuttersäure oder Bausteinen mit einer Kettenlänge von C6-C14, in Escherichia coli etabliert.
Forschungsschwerpunkt ist die Etablierung neuer PHA-Biosynthesewege in rekombinanten Produktionsstämmen durch 'metabolic engineering'. Hierzu ist es ebenso erforderlich, dass neue Gene identifiziert werden, deren Genprodukte eine nützliche Funktion für die Etablierung neuer Stoffwechselwege haben könnten. Dadurch sollten möglichst viele PHAs aus einfachen und preiswerten Kohlenstoffquellen und nicht wie bisher überwiegend aus teuren und z.T. toxischen Vorstufensubstraten synthetisiert werden können.
Publikationen zu diesem Thema
In vitro Biosynthese von PHAs
  |
|
Abb. 3 |
Die zellfreie in vitro Biosynthese von PHAs erlaubt die Synthese von definierten PHAs und ermöglicht die biochemische enzymologische Untersuchung von an der PHA-Biosynthese beteiligten Enzymen. Untersuchungen zur in vitro PHA-Biosynthese ermöglichen grundsätzlich die Etablierung der entsprechenden PHA-Biosynthesewege in vivo. Da die in vitro PHA-Biosynthese entweder aktivierte Vorstufen (Coenzym A Thioester) oder für die Aktivierung energiereich Phosphatester benötigt, ist die zellfreie Biosynthese von PHAs ein sehr teures Verfahren. Durch das Recyclisieren von Cofaktoren sind die Synthesekosten bereits deutlich gesunken.
Im Arbeitskreis wurden verschiedene in vitro Biosyntheseverfahren entwickelt, die von der einstufigen Synthese bis zur dreistufigen Synthese reichen und die es ermöglichen, unterschiedliche definierte und hochmolekulare PHAs zu synthetisieren. Forschungsschwerpunkt der Arbeitsgruppe ist es, in vitro Biosyntheseverfahren zu entwickeln, die zur Synthese neuer Polyester mit neuartigen Materialeigenschaften führen. Zudem soll die in vitro Biosynthese genutzt werden, um die an der Synthese beteiligten Enzyme molekular zu charakterisieren.
Publikationen zu diesem Thema
Biotechnologische Produktion von PHAs
 |
 |
|
Abb. 4 PHB-Granulat, welches für die Weiterverarbeitung (z.B. für Verpackungen) zur Verfügung steht (oben). Fermenter im 30 l Maßstab der Fa. Braun, Melsungen (unten) |
Erkenntnisse, die über den Stoffwechsel von PHAs sowie über die Biochemie der PHA Synthasen gewonnen wurden, und auch gentechnisch veränderte Bakterien werden zur Etablierung neuer oder verbesserter Verfahren zur biotechnologischen Produktion von PHAs herangezogen. Diese Untersuchungen sollen die Nutzung nachwachsender Rohstoffe (Saccharose, Lipide, Lävulinsäure), Abfall- und Reststoffe der Landwirtschaft (Melasse, Molke) und chemischen Industrie (Restöl aus Rhamnoseproduktion) sowie fossiler Rohstoffe (Braunkohle) zur kostengünstigen fermentativen Produktion von PHAs erschließen.
Außerdem sollen neue PHAs und PHAs mit besonderen Bausteinen in ausreichenden Mengen bereitgestellt werden, damit die physikalischen Eigenschaften und Materialeigenschaften sowie die Verarbeitung dieser PHAs erforscht werden können. Außerdem sollen hierdurch Untersuchungen zum biologischen Abbau dieser PHAs ermöglicht werden.
Hierzu steht dem Arbeitskreis ein neues Biotechnikum mit Bioreaktoren für die Anzucht von heterotrophen Bakterien im Maßstab von bis zu 500 L sowie einen Photobioreaktor zur Kultivierung phototropher Mikroorganismen im 80 L Maßstab zur Verfügung. Außerdem können extrem halophile Archaebakterien in einem korrosionsgeschützten Bioreaktor im 10 L Maßstab kultiviert werden.
In Kooperation mit Pflanzenzüchtern wird außerdem angestrebt, transgene Pflanzen zur Produktion von PHAs zu erzeugen. Der Beitrag des Arbeitskreises besteht dabei in der Bereitstellung von Genen, die für die Biosynthese von PHAs wichtig sind, und in der Analyse von Proteinen.
Publikationen zu diesem Thema
Struktur und Aufbau von PHA Grana
PHAs werden in der Bakterienzelle in Form cytoplasmatischer Einschlüsse als Speicherstoff abgelagert. Diese PHA-Grane sind von einer aus Proteinen und Phospholipiden bestehenden Hüllmembran umgeben. Neben der PHA Synthase und wahrscheinlich auch der PHA Depolymerase, die beide nur einen relativ geringen Anteil der Hüllproteine ausmachen, kommt in allen PHA akkumulierenden Bakterien mindestens ein weiteres, von der Menge her dominierendes Protein vor.
Poly(3HB) akkumulierende Bakterien wie Ralstonia eutropha besitzen meist nur ein weiteres Hüllprotein. Es handelt sich dabei um ein amphiphiles Protein mit meist niedrigem Molekulargewicht, welches außerordentlich fest an die Granaoberfläche gebunden ist. Diese in Analogie an die die Triglycerid-Einschlüsse in Pflanzenzellen umgebenden Oleosine als Phasine bezeichneten Proteine wurden erstmals in Poly(3HB)-leaky Mutanten von R. eutropha entdeckt. Fehlt das 24-KDa Phasinprotein, akkumulieren die Zellen weniger Poly(3HB), und in den Zellen kommt im Gegensatz zum Wildtyp nur noch ein einziges, sehr großes PHA Granulum vor. Da die Oberfläche der PHA-Grana in diesen Mutanten weitgehend "nackt" vorliegt, verschmelzen die Grana mit den hydrophoben PHA Molekülen miteinander.
 |
 |
|
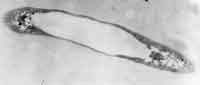
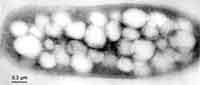
Abb. 5 Elektronenmikroskopische Aufnahmen von Mutanten des Bakteriums R. eutropha: oben, Phasin negative Mutante, unten, Repressorprotein negative Mutante. |
Neben dem Phasin aus R. eutropha wurde auch das Phasin aus Rhodococcus ruber untersucht. Detaillierte biochemische und molekulargenetische Untersuchungen wurden durchgeführt um die Funktion dieser neuen Proteinklasse, deren Binderegion an die Grana, und deren Einfluß auf die Synthese von PHAs aufzuklären. Die Expression des Phasingens (phaP) wird in R. eutropha durch das Repressorprotein PhaR reguliert, welches an die PHA-Grana sowie an die Promotorregionen von phaP und phaR binden kann. Durch die Herstellung von PhaR-Mutanten konnte gezeigt werden, dass eine Überexpression von PhaP zur Bildung einer erhöhten Anzahl von Grana führt.
Publikationen zu diesem Thema
Regulation des PHA Stoffwechsels
Über die Regulation der PHA Biosynthese und dem intrazellulären Abbau ist relativ wenig bekannt. Wir untersuchen Ralstonia eutropha als Modellorganismus um Licht in diese wenig untersuchten Vorgänge zu bringen.
In R. eutropha werden die Enzyme für die Biosynthese konstitutiv exprimiert. Offensichtlich sind die intrazellulären Konzentrationen von Acetyl-CoA und freiem CoenzymA und die allosterische ß-Ketothiolase entscheidend dafür, ob die Synthese von Poly(3HB) einsetzt und die Zellen den Speicherstoff akkumulieren können. Im Gegensatz hierzu wird die Expression des Phasinproteins und wahrscheinlich auch der am intrazellulären Abbau beteiligten Enzyme auf der Ebene der Transkription und/oder Translation reguliert. Ein Regulatorprotein, welches in diesen Vorgang involviert ist, wurde identifiziert. Darüber hinaus wurden zwei Gene identifiziert, deren Translationsprodukte Homologien zu Komponenten des PEP: Phosphotransferase-Systems anderer Bakterien aufweisen (HPr und Enzym-I). Diese Gene (phaH und phaI) sind ebenfalls an der Regulation beteiligt. Die uns bekannten Regulatorproteine werden gegenwärtig biochemisch und molekulargenetisch untersucht (siehe auch "Struktur und Aufbau der PHA-Grana").
Publikationen zu diesem Thema
Poly(malat)
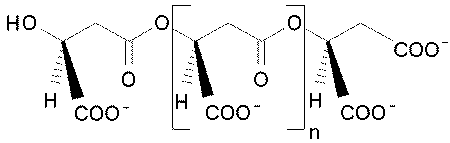 |
|
Abb. 6 Poly(malat) |
In einem Stamm von A. pullulans wurde die Synthese von PMA detaillierter im Hinblick auf die anzuwendenden Kulturbedingungen, die Kohlenstoffquelle, den Einfluß von Inhibitoren und das polymerisierende Enzym untersucht. Es deutete sich an, dass PMA offensichtlich durch ein von den PHA Synthasen unterschiedliches Enzymsystem synthetisiert wird. Für A. pullulans wurde ein Plasmidvektor für die Übertragung von DNA entwickelt.
Darüber hinaus wurde PMA fermentativ in größeren Mengen produziert und isoliert. Außerdem wurden Bakterien isoliert, die PMA abbauen und als alleinige Kohlenstoffquelle zum Wachstum nutzen konnten.
Publikationen zu diesm Thema
Stichwörter
Acetoacetyl-CoA Reduktase, Acrylsäure, Alcaligenes eutropha, Allochromatium vinosum, Arabidopsis thaliana, Aureobasidium pullulans, Bacillus megaterium, Biologisch abbaubare Polymere, Biopol, Burkholderia cepacia, Burkholderia sacchari, Chromatium vinosum,Chromobacterium violaceum, Clostridium acetobutylicum, Comamonas acidovorans, Copolyester, Cyanobakterien, Esterase, Fettsäurestoffwechsel, Granula, 3-Hydroxy-ACP-CoA Transferase, 3-Hydroxybuttersäure, 4-Hydroxybuttersäure, in vitro Synthese, ß-Ketothiolase, Lävulinsäure, 3-Mercaptopropionsäure, Metabolic engineering, Methylobacterium extorquens, Mycoplana rubra, Nachwachsende Rohstoffe, Nilrot, PEP - Phosphotransferasesystem, PHA, PHA-leaky Mutanten, PHA-negative Mutanten, PHA Depolymerase, PhaA, PhaB, PhaC, PhaG, PhaR, PhaP1, PhaP2, PhaP3, PhaP4, Phasine, PHA Synthase, PHB, PHF Synthase, Polyester, Polyhydroxyalkanoate, Polyhydroxyfettsäuren, Polymalat, Pseudomonas aeruginosa, Pseudomonas fragi, Pseudomonas mendocina,Pseudomonas oleovorans, Pseudomonas putida, Pseudomonas saccharophila, PtsH, PtsI, Ralstonia eutropha, Rhodobacter sphaeroides, Rhodococcus ruber, Rhodospirillum rubrum, Speicherstoffe, Succinatsemialdehyd Dehydrogenase, Sudanschwarz, Synechococcus sp. strain MA19,Synechocystis sp. strain PCC6803, Thiocapsa pfennigii, Thiocystis violacea, Thioesterase,Umbellularia californica
Am Projekt beteiligte Mitarbeiter
| Zur Zeit: | Matthias Raberg Jessica Eggers Nicole Lindenkamp Elena Volodina Herbert Ahlers |
| Früher | Amro Amara Andreas Pries Andreas Renkert Arnulf Timm Astrid Hoppensack Axel Bethke |
| Beatriz S. Mendez Bernd Füchtenbusch Bernd H. A. Rehm Bianca Uischner |
|
| Carmen Dudek Carolin Gödde Chlud Kaddor Christian Brämer Christina Föllner |
|
| Daniel Mergelkamp Dieter Jendrossek Dirk Baumeister Dirk Fabritius |
|
| Felix Godoy Folke Hosefelder Francis Hezayen Frank Eckert Frank Reinecke |
|
| Gundula Zwingmann Gustavo J. Vazquez |
|
| Hector M. Alvarez Helena Müller Henrike Knizia Henry Valentin |
|
| Ingo Voß Ingrid Knocke Isabelle Twilfer |
|
| Jan Bechmann Jonas Schlüter Jürgen Paletta |
|
| K. Sonomoto Karsten Rose Katja Peplinski Kenny Kuchta Kerstin Brandt Kerstin Brückener Kristin Aerts |
|
| Liv Neumann | |
| Markus Pötter Martin Lahrkamp Matthias Liebergesell Mohammad H. A. Ibrahim M. Filomena A. Rodrigues Marc Wältermann |
|
| Niels Krüger Nils Hoffmann |
|
| Patricia Spiekermann Peter Schubert Qingsheng Qi R. Habibian Rainer Kalscheuer Ralf Jossek Regina V. Antonio Roman Wieczorek |
|
| Sandra Kohaus Shuangjiang Liu Shuishan Song Silke Fiedler Silke Hein Silvia Heiss Stefan Langenbach Stefan Wiese Stefanie Grote |
|
| Timo Stiefermann Tina Lütke-Eversloh Tran Hai Ulrike Brandt Ursula Pieper-Fürst Uwe Oelmüller Uwe Remminghorst Volker Gorenflo |
| Koorperationspartner, Förderung, Finanzierung |
In den letzten ca. 15 Jahren wurden die Untersuchungen häufig im Rahmen von Kooperationen mit Partnern aus dem In- und Ausland durchgeführt. Finanzielle Unterstützungen wurden dabei von zahlreichen öffentlichen Institutionen und Partnern aus der Industrie erhalten.Kooperationspartner:Institut für Physik der Westfälischen Wilhelms- Universität Münster, Germany (Prof. Dr. H. Eckert)Institut für Physik der Westfälischen Wilhelms- Universität Münster, Germany (Prof. Dr. H. Fuchs) Institut für Mikrobiologie und Genetik der Georg-August-Universität Göttingen, Germany (Prof. Dr. F. Mayer, Dr. M. Madkour, Prof. Dr. G. Gottschalk, Dr. B. Söhling) Institut für Organische Chemie der Westfälischen Wilhelms-Universität Münster, Germany (Dr. H. Luftmann, Dr. K. Bergander) Institut für Biochemie und Chemosensorik der TU Hannover, Germany (Prof. Dr. T. Scheper) Institut für Polymerforschung Dresden e.V., Germany (Dr. G. Schmack) Umweltforschungszentrum Leipzig, Germany (Prof. Dr. W. Babel, Dr. C. Föllner) Institut für Pflanzenzüchtung der Christian-Albrechts-Universität Kiel, Germany (Prof. Dr. C. Jung) Botanisches Institut der Universität München, Germany (Prof. Dr. H.-U. Koop) Max-Planck-Institut für Molekulare Pflanzenphysiologie, Golm, Germany (Prof. Dr. L. Willmitzer) Gesellschaft für Biotechnologische Forschung, Braunschweig, Germany (Prof. Dr. R. Jonas) Institut für Biotechnologie - ETH Zürich, Switzerland (Prof. Dr. B. Witholt) ATO, Wageningen, The Netherlands (Dr. G. Eggink, Dr. H. Mooibroek) Institut de Biologie et Physiologie Végétales, University of Lausanne, Switzerland (Prof. Dr. Y. Poirier) IPT, Sao Paolo, Brazil (Dr. L. Ferreria, Dr. F. Rodrigues) Departamento. de Quimica Biologia, University of Buenos Aires, Argentina (Prof. Dr. B. Mendez) Instituto de Biociencias, Universidade Federal Do Rio Grande Do Sul, Brazil (Prof. Dr. A. Henriques) KAIST, Taejon, Korea (Prof. Dr. S.-Y. Lee) Department of Chemistry, Pulp and Paper Research Center, McGill University, Montreal, Canada (Prof. Dr. R. Marchessault) Depto de Bioquímica, Universidad Nacional de la Patagonia San Juan Bosco, Comodora Rivadavia, Argentina (Prof. Dr. H. Alvarez) Department of Botany and Microbiology, Alexandria University, Egypt (Prof. Dr. S. Omar) Fa.Planta (Einbeck, Germany) Finanzielle Unterstützung:Deutsche Forschungsgemeinschaft (Bonn, Germany)Bundesministerium für Wirtschaft und Technologie - BMBF (Bonn, Germany) Bundesministerium für Verbraucherschutz, Ernährung und Landwirtschaft - BMVEL (Bonn, Germany) GenoMik Netzwerk (Göttingen, Germany) Deutscher Akademischer Austauschdienst - DAAD (Bonn, Germany) Deutsche Forschungsanstalt für Luft- und Raumfahrt - DLR Alexander von Humboldt Stiftung (Bonn, Germany) Max-Buchner Forschungsstiftung der DECHEMA (Frankfurt, Germany) Fonds der Chemischen Industrie (Frankfurt, Germany) Europäische Union - DG XII (Brüssel, Belgium) Imperial Chemical Industries / Zeneca (London, UK) Monsanto (St. Louis, USA) Metabolix Inc. / Tepha Inc. (Cambridge, USA) |
Publikationen
Schlüsselenzyme: PHA Synthase
- Rehm, B. H. A., N. Hoffmann, Q. Qi, S. Fiedler, and A. Steinbüchel. 2004. Biosynthesis of latex-like polyhydroxyalkanoates. Proceedings of the "International Symposium on Bioconversion of Renewable Raw Materials" in Braunschweig, in press.
- Hai, T., D. Lange, R. Rabus, and A. Steinbüchel. 2004. Polyhydroxyalkanoate (PHA) accumulation in sulfate-reducing bacteria and identification of a class-III PHA synthase (PhaEC) in Desulfococcus multivorans. Appl. Environ. Microbiol. 70:4440-4448.
- Hezayen, F., B. H. , A. Steinbüchel, and B. H. A. Rehm. 2002. Biochemical and enzymological properties of the polyhydroxybutyrate synthase from the extremely halophilic archaeon strain 56. Arch. Biochem. Biophys. 403:284-291.
- Amara, A. A., A. Steinbüchel, and B. H. A. Rehm. 2002. In vivo evolution of the Aeromonas punctata polyhydroxyalkanoate (PHA) synthase: Isolation and characterization of modified PHA synthases with enhanced activity. Appl. Microbiol. Biotechnol. 59:477-482.
- Hein, S., J. Paletta, and A. Steinbüchel. 2002. Cloning, characterization and comparison of the Pseudomonas mendocina polyhydroxyalkanoate synthases PhaC1 and PhaC2. Appl. Microbiol. Biotechnol. 58:229-236.
- Green, P. R., J. Kemper, L. Schechtman, L. Guo, M. Satkowski, S. Fiedler, A. Steinbüchel, and B. H. A. Rehm. 2002. Formation of short chain length/medium chain length polyhydroxyalkanoate copolymers by fatty acid ß-oxidation inhibited Ralstonia eutropha. BioMacromolecules 3:208-213.
- Rehm, B. H. R., R. V. Antonio, P. Spiekermann, A. A. Amara, and A. Steinbüchel. 2001. Molecular characterization of the poly(3-hydroxybutyrate) (PHB) synthase from Ralstonia eutropha: In vitro evolution, site-specific mutagenesis and development of PHB synthase protein model. Biochim. Biophys. Acta 1594:178-190.
- Pettinari, M. J., G. J. Vazquez, D. Silberschmidt, B. H. A. Rehm, A. Steinbüchel, and B. S. Mendez. 2001. Poly(3-hydroxybutyrate) synthesis genes in Azotobacter chroococcum strain FA8. Appl. Environ. Microbiol. 67:5331-5334.
- Hai, T., S. Hein, and A. Steinbüchel.2001. Multiple evidence for widespread and general occurrence of type-III PHA synthases in cyanobacteria and molecular characterization of the PHA synthases from two thermophilic cyanobacteria: Chlorogloeopsis fritschii strain PCC6912 and Synechococcus sp. strain MA19. Microbiology 147:3047-3060.
- Rehm, B. H. A., Q. Qi, Br. B. Beermann, H.-J. Hinz and A. Steinbüchel.2001. Matrix-assisted in vitro refolding of Pseudomonas aeruginosa class II polyhydroxyalkanoate synthase from inclusion bodies produced in recombinant Escherichia coli. Biochem. J. 358:263-268.
- Steinbüchel, A., and S. Hein.2001. Biochemical and molecular basis of polyhydroxyalkanoic acids in microorganisms. In: Biopolyesters (A. Steinbüchel and W. Babel, Eds.), Adv. Biochem. Eng. Biotechnol. 71:81-123.
- Rehm, B. H. A., and A. Steinbüchel. 2001. PHA synthases – the key enzymes of PHA synthesis. In: Y. Doi and A. Steinbüchel (eds.) Biopolymers, 1st Edition, Wiley-VCH, Weinheim, pp. 173-215.
- Rodrigues, F. M. de A., E. J. Vicente and A. Steinbüchel. 2000. Studies on PHA accumulation in a polyhydroxyalkanoate synthase-negative mutant of Burkholderia cepaciagenerated by homogenotization. FEMS Microbiol. Lett. 193:179-185
- Liebergesell, M., S, Rahalkar, and A. Steinbüchel. 2000. Analysis of the Thiocapsa pfennigiipolyhydroxyalkanoate synthase: subcloning, molecular characterization and generation of hybrid synthases with the corresponding Chromatium vinosum enzyme. Appl. Microbiol. Biotechnol. 54:186-194.
- Rodrigues, F., H.E. Valentin, P.A. Berger, M. Tran, J.M Asrar, K. Gruys, and A. Steinbüchel.2000. Polyhydroxyalkanoate accumulation in Burkholderia sp.: a molecular approach to elucidate the genes involved in fromation of two distinct short-chain homopolymers. Appl. Microbiol. Biotechnol. 53:453-460.
- Clemente, T., D. Shah, M. Tran, D. Stark, S. Padgette, D. Dennis, K. Brückener, A. Steinbüchel, and T. Mitsky. 2000. Sequence of PHA synthase gene from two strains ofRhodospirillum rubrum and In vivo substrate specificity of four PHA synthases across two heterologous expression systems. Appl. Microbiol. Biotechnol. 53:420-429.
- Antonio, R.V., A. Steinbüchel, and B.H.A. Rehm. 2000. Analysis of in vivo substrate specificty of the PHA synthase from Ralstonia eutropha: Formation of novel copolyesters in recombinantEscherichia coli. FEMS Microbiol. Lett. 182:111-117.
- Spiekermann, P., B. H. A. Rehm, R. Kalscheuer, D. Baumeister and A. Steinbüchel. 1999. A sensitive, viable colony staining method using Nile Red for direct screening of bacteria that accumulate polyhydroxyalkanoic acids and other lipid storage compounds. Arch. Microbiol.171:73-78.
- Rehm, B. H. A. and A. Steinbüchel. 1999. Biochemical and genetic analysis of PHA synthases and other proteins required for PHA synthesis. Int. J. Biol. Macromol. 25:3-19.
- Hein, S., T. Hai, and A. Steinbüchel. 1998. Synechocystis sp. PCC6803 possesses a two-component polyhydroxyalkanoic acid synthase like anoxygenic purple sulfur bacteria. Arch. Microbiol. 170:162-170.
- Qingsheng, Qi, B. H. A. Rehm, and A. Steinbüchel. 1997. Synthesis of poly(3-hydroxyalkanoates) in Escherichia coli expressing the PHA synthase gene phaC2 fromPseudomonas aeruginosa: comparison of PhaC1 and PhaC2. FEMS Microbiol. Lett. 157:155-162.
- Langenbach, S., B. H. A. Rehm, and A. Steinbüchel. 1997. Functional expression of the PHA synthase gene phaC1 from Pseudomonas aeruginosa in Escherichia coli results in poly(3-hydroxyalkanoate) synthesis. FEMS Microbiol. Lett. 150:303-309.
- Liebergesell, M. and A. Steinbüchel. 1996. New knowledge about the pha-locus and PHA granule-associated proteins in Chromatium vinosum. Biotechnol. Lett. 18:719-724.
- Liebergesell, M., K. Sonomoto, M. Madkour, F. Mayer, and A. Steinbüchel. 1994. Purification and characterization of the poly(hydroxyalkanoic acid) synthase from Chromatium vinosum and localization of the enzyme at the surface of poly(hydroxyalkanoic acid) granules. Eur. J. Biochem. 226:71-80.
- Timm, A., S. Wiese and A. Steinbüchel. 1994. A general method for cloning of polyhydroxyalkanoic acid-synthase genes from pseudomonads belonging to the rRNA homology group I. Appl. Microbiol. Biotechnol. 40:669-675.
- Valentin, H. E. and A. Steinbüchel. 1994. Application of enzymatically synthesized short-chain-length hydroxy fatty acid coenzyme A thioesters for assay of polyhydroxyalkanoic acid synthases. Appl. Microbiol. Biotechnol. 40:699-709.
- Liebergesell, M., F. Mayer and A. Steinbüchel. 1993. Analysis of polyhydroxyalkanoic acid-biosynthesis genes of anoxygenic phototrophic bacteria reveals synthesis of a polyester exhibiting an unusual composition. Appl. Microbiol. Biotechnol. 40:292-300.
- Hustede, E., and A. Steinbüchel. 1993. Characterization of the polyhydroxyalkanoate synthase gene locus of Rhodobacter sphaeroides. Biotechnol. Letters 15:709-714.
- Valentin, H. and A. Steinbüchel. 1993. Cloning and characterization of the Methyolobacterium extorquens polyhydroxyalkanoic acid synthase structural gene. Appl. Microbiol. Biotechnol.39:309-317.
- Liebergesell, M., and A. Steinbüchel. 1993. Cloning and molecular characterization of the poly(3-hydroxybutyric acid)-biosynthetic genes of Thiocystis violacea. Appl. Microbiol. Biotechnol. 38:493-501.
- Liebergesell, M., B. Schmidt, and A. Steinbüchel. 1992. Isolation and identification of granule-associated proteins relevant for poly(3-hydroxybutyric acid) biosynthesis in Chromatium vinosum D. FEMS Microbiol. Lett. 99:227-232.
- Timm, A., and A. Steinbüchel. 1992. Cloning and molecular characterization of the polyhydroxyalkanoic acid gene locus of Pseudomonas aeruginosa PAO1. Eur. J. Biochem.209:15-30.
- Liebergesell, M., and A. Steinbüchel. 1992. Cloning and nucleotide sequences of genes relevant for biosynthesis of polyhydroxyalkanoic acid in Chromatium vinosum strain D. Eur. J. Biochem. 209:135-150.
- Pieper, U., and A. Steinbüchel. 1992. Identification, cloning and sequence analysis of the poly(3-hydroxyalkanoic acid) synthase gene of the Gram-positive bacterium Rhodococcus ruber. FEMS Microbiol. Lett. 96:73-80.
- Hustede, E., Steinbüchel, A., and H. G. Schlegel. 1992. Cloning of poly(3-hydroxybutyric acid) synthase genes of Rhodobacter sphaeroides and Rhodospirillum rubrum and heterologous expression in Alcaligenes eutrophus. FEMS Microbiol. Lett., 93:285-290.
- Preusting, H., J. Kingma, G. Huisman, A. Steinbüchel, and B. Witholt. 1992. Formation of polyester blends by a recombinant strain of Pseudomonas oleovorans: different poly(3-hydroxyalkanoates) are stored in separate granules. J. Environ. Polym. Degrad. 1:45-53.
- Steinbüchel, A., Hustede E., Liebergesell, M., Timm, A., Pieper, U., and H. Valentin. 1992. Molecular basis for biosynthesis and accumulation of polyhydroxyalkanoic acids in bacteria. FEMS Microbiol. Rev. 103:217-230.
- Steinbüchel, A., and H. G. Schlegel. 1991. Genetics of poly(ß-hydroxyalkanoic acid) synthesis in Alcaligenes eutrophus. Mol. Microbiol. 5:535-542.
- Schubert, P., Krüger, N., and A. Steinbüchel. 1991. Molecular analysis of the Alcaligenes eutrophus poly(3-hydroxybutyrate)-, PHB-, biosynthetic operon: identification of the N-terminus of PHB-synthase and identification of the promotor. J. Bacteriol. 173:168-175.
- Steinbüchel, A., N. Krüger, H. Valentin, A. Timm, A. Pries, E. Hustede, and H. G. Schlegel.1991. Physiological and genetic analysis of polyhydroxyalkanoate biosynthetic pathways. InPseudomonas: molecular biology and biotechnology, E. Galli, S. Silver and B. Witholt (eds.) American Society for Microbiology, Washington D.C., pp. 315-327.
- Steinbüchel, A., P. Schubert, A. Timm, and A. Pries. 1990. Genetic analysis of the Alcaligenes eutrophus poly(hydroxyalkanoate)-synthetic genes and accumulation of PHA in recombinant bacterial strains. In E. A. Dawes (ed.) Novel biodegradable microbial polymers. Kluwer Academic Publishers, Dordrecht, pp. 143-159.
- Timm, A., D. Byrom, and A. Steinbüchel. 1990. Formation of blends of various poly(3-hydroxyalkanoic acids) by a recombinant strain of Pseudomonas oleovorans. Appl. Microbiol. Biotechnol. 33:296-301.
- Schubert, P., A. Pries, N. Krüger, and A. Steinbüchel. 1990. Molecular analysis of theAlcaligenes eutrophus PHB-biosynthetic genes: identification of the NH2-terminus of PHB synthase and identification of the transcription start site of phbC. In E. A. Dawes (ed.) Novel biodegradable microbial polymers. Kluwer Academic Publishers, Dordrecht, pp. 447-448.
- Schubert, P., A. Steinbüchel, and H. G. Schlegel. 1989. Genes involved in the synthesis of poly(ß-hydroxyalkanoic acid) in Alcaligenes eutrophus. In: D. Behrens and A. J. Driesel (eds.) DECHEMA-Biotechnology-Conferences, Vol. 3 Part A, pp. 433-436.
- Steinbüchel, A. and P. Schubert. 1989. Expression of the Alcaligenes eutrophuspoly(ß-hydroxybutyric acid)-synthetic pathway in Pseudomonas sp.. Arch. Microbiol.153:101-104.
- Schubert, P., A. Steinbüchel, and H. G. Schlegel. 1988. Cloning of the Alcaligenes eutrophusgene for synthesis of poly-ß-hydroxybutyric acid and synthesis of PHB in Escherichia coli. J. Bacteriol. 170:5837-5847.
- Schubert, P., A Steinbüchel, and H. G. Schlegel. 1988. Synthesis of poly-ß-hydroxybutyric acid in Alcaligenes eutrophus, its genetic localization and conjugational transfer of the genes. Nachrichten der Akademie der Wissenschaften Göttingen. II. Mathematisch-Physikalische Klasse, Nr. 4, pp. 1-10.
Anabolismus von PHAs
- Lindenkamp, N., Volodina, E., and A. Steinbüchel. 2012. Genetically Modified Strains of Ralstonia eutropha H16 with β-Ketothiolase Gene Deletions for Production of Copolyesters with Defined 3-Hydroxyvaleric Acid Contents. Appl Environ Microbiol 78:5375-5383.
- Brandt, U., Raberg, M., Voigt, B., Hecker, M., and A. Steinbüchel. 2012. Elevated poly(3-hydroxybutyrate) synthesis in mutants of Ralstonia eutropha H16 defective in lipopolysaccharide biosynthesis. Appl Microbiol Biotechnol 95:471-483.
- Lindenkamp, N., Peplinski, K., Volodina, E., Ehrenreich, A., and A. Steinbüchel. 2010. Impact of multiple beta-ketothiolase deletion mutations in Ralstonia eutropha H16 on the composition of 3-mercaptopropionic acid-containing copolymers. Appl Environ Microbiol 76:5373-5382.
- Rehm, B. H. A., N. Hoffmann, Q. Qi, S. Fiedler, and A. Steinbüchel. 2004. Biosynthesis of latex-like polyhydroxyalkanoates. Proceedings of the "International Symposium on Bioconversion of Renewable Raw Materials" in Braunschweig, pp. 163-175.
- Steinbüchel, A. and T. Lütke-Eversloh. 2003. Metabolic engineering and pathway construction for biotechnological production of relevant polyhydroxyalkanoates in microorganisms. Biochem. Eng. J. 16:81-96.
- Steinbüchel, A. 2003. In vivo and in vitro metabolic engineering of PHA biosynthesis pathways. In: H. N. Cheng and R. A. Gross (eds.) Biocatalysis in Polymer Science. ACS Symposium Book series 840, pp. 120-123
- Godoy, F., M. Vancanneyt, M. Martinez, A. Steinbüchel, J. Swings, and B. H. A. Rehm. 2003. Sphingopixis chilensis sp. nov. a chlorophenol degrading bacterium that accumulates polyhydroxyalkanoate and transfer of Sphingomonas alaskensis to Sphingopixis alaskensis comb. nov. Int. J. Syst. Evol. Microbiol. 53:473-477.
- Hezayen, F. F., B. J. Tindall, A. Steinbüchel, and B. H. A. Rehm 2002. Characterization of a novel halophilic archaeon Halobiforma haloterrestris gen. nov., sp., nov., and transfer of Natronobacterium nitratireducens to Halobiforma nitratireducens comb. nov.. Int. J. Syst. Evol. Microbiol. 52:2271-2280
- Fiedler, S. A. Steinbüchel, and B. H. A. Rehm. 2002. The role of the fatty acid ß-oxidation multienzyme complex from Pseudomonas oleovorans in polyhydroxyalkanoate biosynthesis: Molecular characterization of the fadBA operon from P. oleovorans and of the enoyl-CoA hydratase genes phaJ from P. oleovorans and P. putida. Arch. Microbiol. 178:149-160.
- Bohmert, K., I. Balbo, A. Steinbüchel., G. Tischendorf, and L. Willmitzer. 2002. Constitutive expression of the ß-ketothiolase gene in transgenic plants: a major obstacle for obtaining polyhydroxybutyrate producing plants. Plant Physiol. 128:1282-1290.
- Hein, S., J. Paletta, and A. Steinbüchel. 2002. Cloning, characterization and comparison of thePseudomonas mendocina polyhydroxyalkanoate synthases PhaC1 and PhaC2. Appl. Microbiol. Biotechnol. 58:229-236.
- Green, P. R., J. Kemper, L. Schechtman, L. Guo, M. Satkowski, S. Fiedler, A. Steinbüchel, and B. H. A. Rehm. 2002. Formation of short chain length/medium chain length polyhydroxyalkanoate copolymers by fatty acid ß-oxidation inhibited Ralstonia eutropha. BioMacromolecules 3:208-213.
- Brämer, C. , L.F. Silva, J. G. C. Gomez, H. Priefert, and A. Steinbüchel. 2002. Identification of the 2-methylcitrate pathway involved in the catabolism of propionate in the polyhydroxyalkanoate producing bacterium Burkholderia sp. IPT-101 and analysis of a mutant accumulating a copolyester with higher 3-hydroxyvalerate content. Appl. Environ. Microbiol.68:271-279.
- Brämer, C. O., P. Vandamme, L. F. da Silva, J. G. C. Gomez and A. Steinbüchel. 2001.Burkholderia sacchari, sp. nov., a polyhydroxyalkanoate-acumulating bacterium isolated from soil of a sugar-cane plantation in Brazil. Int. J. Syst. Evol. Microbiol. 51:1709-1713.
- Omar, S., A. Rayes, A. Eqaab, I. Voß, and A. Steinbüchel. 2001. Effect of different cultivation conditions on cell growth and poly(3-hydroxybutyrate) accumulation in a Bacillus megateriumstrain isolated from Saudi-Arabia. Biotechnol. Lett. 23:1119-1123.
- Rehm, B. H. A., T. A. Mitsky, and A. Steinbüchel. 2001. Role of fatty acid de novo biosynthesis in polyhydroxyalkanoic acid (PHA) and rhamnolipid synthesis by pseudomonads: Establishment of the transacylase (PhaG) -mediated PHA biosynthesis in Escherichia coli. Appl. Environ. Microbiol. 67:3102-3109.
- Jung, C., and A. Steinbüchel. 2001. Bioplastik aus Nutzpflanzen. Biologie in unserer Zeit 31:250-258.
- Steinbüchel, A. 2001. Perspectives for biotechnological production and utilization of biopolymers: Metabolic engineering of polyhydroxyalkanoate biosynthesis pathways as a successful example. Macromol. Bioscience 1:1-24.
- Steinbüchel, A., and S. Hein. 2001. Biochemical and molecular basis of polyhydroxyalkanoic acids in microorganisms. In: Biopolyesters (A. Steinbüchel and W. Babel, Eds.), Adv. Biochem. Eng. Biotechnol. 71:81-123.
- Rehm, B. H. A. and A. Steinbüchel. 2001. Heterologous expression of the acyl-acyl carrier protein thioesterase gene from the plant Umbellularia californica mediates poyhydroxyalkanoate biosynthesis in recombinant Escherichia coli. Appl. Microbiol. Biotechnol. 55:205-209.
- Steinbüchel, A., I. Voß and V. Gorenflo. 2000. Interesting carbon sources for biotechnological production of biodegradable polyesters: the use of rape seed oil methyl ester (biodiesel). ACS Symposium Series 764 "Polymers from Renewable Resources. Biopolyesters and Biocatalysis" (eds. C. Scholz and R. A. Gross), Oxford University Press, pp. 14-24.
- Rodrigues, F. M. de A., E. J. Vicente and A. Steinbüchel. 2000. Studies on PHA accumulation in a polyhydroxyalkanoate synthase-negative mutant of Burkholderia cepaciagenerated by homogenotization. FEMS Microbiol. Lett. 193:179-185
- Hoffmann, N., B. H. A. Rehm and A. Steinbüchel. 2000. Homologous functional expression of cryptic phaG from Pseudomonas oleovorans establishes the transacylase-mediated polyhydroxyalkanoate biosynthesis pathway. Appl. Microbiol. Biotechnol. 54:665-670.
- Fiedler, S., A. Steinbüchel, and B. H. A. Rehm. 2000. PhaG-mediated synthesis of poly(3-hydroxyalkanoates) consisting of medium-chain-length constituents from non-related carbon sources in recombinant Pseudomonas fragi. Appl. Environ. Microbiol. 66:2117-2124.
- Song, S., S. Hein, and A. Steinbüchel. 2000. Cloning, nucleotide sequence and primary biochemical characterization of esterase EstA from Ralstonia eutropha CH34. Biotechnol. Lett.22:443-449.
- Hoffmann, N., A. Steinbüchel, and B. H. A. Rehm. 2000. The Pseudomonas aeruginosa phaGgene product is involved in the synthesis of polyhydroxyalkanoic acids consisting of medium-chain-length constituents from non-related carbon sources. FEMS Microbiol. Lett.184:253-260.
- Liu, S.-J., and A. Steinbüchel. 2000. A novel genetically engineered pathway for synthesis of poly(hydroxyalkanoic acids) in Escherichia coli. Appl. Environ. Microbiol. 66:739-743.
- Lütke-Eversloh, T. and A. Steinbüchel. 1999. Identification and molecular characterization of a succinate semialdehyde dehydrogenase gene involved in the catabolism of 4-hydroxybutyrate in Ralstonia eutropha. FEMS Microbiol. Lett. 181:63-71.
- Valentin, H. E., P. A. Berger, K. J. Gruys, M. F. de A. Rodriguez, A. Steinbüchel, M. Tran, and J. Asrar. 1999. Polyhydroxyalkanoate accumulation by Burkholderia sp., Macromolecules 32:7389-7395.
- Spiekermann, P., B. H. A. Rehm, R. Kalscheuer, D. Baumeister and A. Steinbüchel. 1999. A sensitive, viable colony staining method using Nile Red for direct screening of bacteria that accumulate polyhydroxyalkanoic acids and other lipid storage compounds. Arch. Microbiol.171:73-78.
- Hoppensack, A., B. H. A. Rehm, and A. Steinbüchel. 1999. Analysis of 4-phosphopantetheinylation of polyhydroxybutyrate synthase from Ralstonia eutropha: generation of ß-alanine auxotrophic Tn5 mutants and cloning of panD gene region.. J. Bacteriol.181:1429-1435.
- Mittendorf, V., E. J. Robertson, R. Leech, N. Krüger, A. Steinbüchel, and Y. Poirier. 1998. Synthesis of medium-chain-length polyhydroxyalkanoates in Arabidopsis thaliana using intermediates of peroxisomal fatty acid ß-oxidation. Proc. Natl. Acad. Sci. USA 95:13397-13402.
- Qingsheng, Qi, A. Steinbüchel, and B. H. A. Rehm. 1998. Metabolic routing towards polyhydroxyalkanoic acid synthesis in recombinant Escherichia coli (fadR): inhibition of fatty acid ß-oxidation by acrylic acid. FEMS Microbiol. Lett. 167:89-94.
- Steinbüchel, A., and B. Füchtenbusch. 1998. Bacterial and other biological systems for polyester production. Trends in Biotechnology 16:419-427.
- Rehm, B. H. A., N. Krüger, and A. Steinbüchel. 1998. A new metabolic link between fatty acid de novo synthesis and polyhydroxyalkanoic acid synthesis. The phaG gene from Pseudomonas putida KT2440 encodes a 3-hydroxyacyl-acyl carrier protein-coenzyme A transferase. J. Biol. Chem. 273:24044-24051.
- Füchtenbusch, B., M. Wältermann, and A. Steinbüchel. 1998. Biotransformation of 2,2-dimethyl-1,3-propanediol to 3-hydroxypivalic acid by Acetobacter acetii DSMZ3508 and related bacteria. Biotechnol. Lett. 20:507-510.
- Steinbüchel, A., C. Brämer, B. Füchtenbusch, V. Gorenflo, T. Hai, S. Hein, R. Jossek, S. Langenbach, Q. Qi, B. H. A. Rehm, and S. Song. 1998. Poly(hydroxyalkanoic acid) biosynthesis pathways. In: A. Steinbüchel (Ed.) Proceedings of the international symposium on "Biochemical Principles and Mechanisms of Biosynthesis and Biodegradation of Polymers" in Münster (Germany), June 3 - 6, 1998, Wiley-VCH publisher, pp. 35 - 47.
- Steinbüchel, A., B. Füchtenbusch, V. Gorenflo, S. Hein, R. Jossek, S. Langenbach and B. H. A. Rehm. 1998. Biosynthesis of polyesters in bacteria and recombinant organisms. Polym. Degrad. Stabil. 59:177-182.
- Qingsheng, Qi, B. H. A. Rehm, and A. Steinbüchel. 1997. Synthesis of poly(3-hydroxyalkanoates) in Escherichia coli expressing the PHA synthase gene phaC2 fromPseudomonas aeruginosa: comparison of PhaC1 and PhaC2. FEMS Microbiol. Lett. 157:155-162.
- Hein, S., B. Söhling, G. Gottschalk, and A. Steinbüchel. 1997. Biosynthesis of poly(4-hydroxybutyric acid) by recombinant strains of Escherichia coli. FEMS Microbiol. Lett.153:411-418.
- Langenbach, S., B. H. A. Rehm, and A. Steinbüchel. 1997. Functional expression of the PHA synthase gene phaC1 from Pseudomonas aeruginosa in Escherichia coli results in poly(3-hydroxyalkanoate) synthesis. FEMS Microbiol. Lett. 150:303-309.
- Steinbüchel, A., S. Hein, M. Huang, N. Krüger and F. B. Oppermann. 1996. Biochemistry and molecular genetics of bacterial TPP-dependent acetoin dehydrogenases. In: H. Bisswanger and A. Schellenberger (Eds.) Biochemistry and Physiology of Thiamin Diphosphate Enzymes, Wissenschaftlicher Verlag A. u. C. Intemann, Prien, pp. 586-599.
- Steinbüchel, A., R. Wieczorek, and N. Krüger. 1996. PHA biosynthesis, its regulation and application of C1-utilizing microorganisms for polyester production. In: M. E. Lidstrom and F. R. Tabita (Eds.) Microbial growth on C1 compounds, Kluwer Academic Publishers, Dordrecht, pp. 237-244.
- Rodriges, M. F. A., da Silva, L. F., J. G. C. Gomez, H. E. Valentin, and A. Steinbüchel. 1995. Biosynthesis of poly(3-hydroxybutyric acid-co-3-hydroxy-4-pentenoic acid) from unrelated substrates by Burkholderia sp., Appl. Microbiol. Biotechnol. 43:880-886.
- Steinbüchel, A. 1995. Mikrobielle und chemische Synthese von biologisch abbaubaren Polyestern. Bakterien als Quelle für thermoplastisch verformbare Polyester aus Hydroxyfettsäuren. Chemie in unserer Zeit 29:260-271.
- Steinbüchel, A., and H. E. Valentin. 1995. Diversity of bacterial polyhydroxyalkanoic acids. FEMS Microbiol. Lett. 128:219-228.
- Valentin, H. E. and A. Steinbüchel. 1995. Accumulation of poly(3-hydroxybutyric acid-co-3-hydroxyvaleric acid-co-4-hydroxyvaleric acid) by mutants and recombinant strains ofAlcaligenes eutrophus. J. Environ. Polym. Degrad. 3:169-175.
- Föllner, C. G., S. Müller, A. Steinbüchel and W. Babel. 1995. Microbial biosynthesis of poly-3-hydroxybutyric acid by the facultatively methanol-assimilating bacterium Mycoplana rubraB346 wild type and recombinant strains. J. Basic Microbiol. 35:179-188.
- Valentin, H. E., G. Zwingmann, A. Schönebaum and A. Steinbüchel. 1995. Metabolic pathway for biosynthesis of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) from 4-hydroxybutyrate by Alcaligenes eutrophus. Eur. J. Biochem. 227:43-60.
- Hein, S., and A. Steinbüchel. 1994. Biochemical and molecular characterization of theAlcaligenes eutrophus pyruvate dehydrogenase complex and identification of a new type of dihydrolipoamide dehydrogenase. J. Bacteriol. 176:4394-4408.
- Lee, S. Y., K. M. Lee, H. N. Chang and A. Steinbüchel. 1994. Comparison of Escherichia colistrains for synthesis and accumulation of poly-(3-hydroxybutyric acid) and morphological changes. Biotechnol. Bioeng. 44:1337-1347.
- Steinbüchel, A., K. A. Malik, and D. Jendrossek. 1994. PHB and other polyhydroxyalkanoic acids as a basis for biodegradable plastics. Proceedings of the 2nd Asia-Pacific Biotechnology Congress ´91, L. L. Ilag and A. K. Raymundo (Eds.) Los Banos, Philippines, pp. 141-153.
- Steinbüchel, A., H. E. Valentin and A. Schönebaum. 1994. Application of recombinant gene technology for production of polyhydroxyalkanoic acids: biosynthesis of poly(4-hydroxybutyric acid) homopolyester. J. Environ. Polym. Degrad. 2:67-74.
- Föllner, C. G., W. Babel, H. E. Valentin and A. Steinbüchel. 1993. Expression of polyhydroxyalkanoic acid-biosynthesis genes in methylotrophic bacteria relying on the ribulosemonophosphate pathway. Appl. Microbiol. Biotechnol. 40:284-291.
- Hustede, E., Steinbüchel, A. and H. G. Schlegel. 1993. Relationship between the photoproduction of hydrogen and the accumulation of PHB in non-sulphur purple bacteria. Appl. Microbiol. Biotechnol. 39:87-93.
- Pries, A., S. Hein, and A. Steinbüchel. 1992. Identification of a lipoamide dehydrogenase gene as second locus affected in poly(3-hydroxyalkanoic acid)-leaky mutants of Alcaligenes eutrophus. FEMS Microbiol. Lett. 97:227-234.
- Steinbüchel, A., and U. Pieper. 1992. Production of copolyesters of 3-hydroxybutyric acid and 3-hydroxyvaleric acid by a mutant of Alcaligenes eutrophus from single unrelated carbon sources. Appl. Microbiol. Biotechnol. 37:1-6.
- Liebergesell, M., E. Hustede, A. Timm, A. Steinbüchel, R. C. Fuller, R. W. Lenz, and H. G. Schlegel. 1991. Formation of poly(3-hydroxyalkanoic acids) by phototrophic and chemolithotrophic bacteria. Arch. Microbiol. 155:415-421.
- Steinbüchel, A. 1991. Polyhydroxyalkanoic acids. In: Biomaterials. D. Byrom (ed.), MacMillan Publishers, Basingstoke, pp. 123-213.
- Steinbüchel, A. 1991. Recent advances in the knowledge of bacterial poly(hydroxy-alkanoic acid) metabolism and potential impacts on the production of biodegradable thermoplastics. Acta Biotechnologica 11:419-427.
- Steinbüchel, A., and H. G. Schlegel. 1991. Genetics of poly(ß-hydroxyalkanoic acid) synthesis in Alcaligenes eutrophus. Mol. Microbiol. 5:535-542.
- Steinbüchel, A., N. Krüger, H. Valentin, A. Timm, A. Pries, E. Hustede, and H. G. Schlegel.1991. Physiological and genetic analysis of polyhydroxyalkanoate biosynthetic pathways. InPseudomonas: molecular biology and biotechnology, E. Galli, S. Silver and B. Witholt (eds.) American Society for Microbiology, Washington D.C., pp. 315-327.
- Timm, A., and A. Steinbüchel. 1990. Formation of polyesters consisting of medium-chain-length 3-hydroxyalkanoic acids from gluconate by Pseudomonas aeruginosaand other fluorescent pseudomonads. Appl. Environ. Microbiol. 56:3360-3367.
- Pries, A., A. Steinbüchel, and H. G. Schlegel. 1990. Lactose and galactose utilizing strains of poly(hydroxyalkanoic acid) accumulating Alcaligenes eutrophus and Pseudomonas saccharophila obtained by recombinant DNA technology. Appl. Microbiol. Biotechnol. 33:410- 417.
- Timm, A., and A. Steinbüchel. 1990. Formation of poly(3-hydroxyalkanoates) by wild type and recombinant strains of Pseudomonas aeruginosa and other fluorescent pseudomonads. In E. A. Dawes (ed.) Novel biodegradable microbial polymers. Kluwer Academic Publishers, Dordrecht, pp. 445-446.
- Steinbüchel, A. and H. G. Schlegel. 1989. Excretion of pyruvate by mutants of Alcaligenes eutrophus, which are impaired in the accumulation of poly(ß-hydroxybutyric acid) (PHB), under conditions permissive for synthesis of PHB. Appl. Microbiol. Biotechnol. 31:168-175.
- Pries, A., A. Steinbüchel, and H. G. Schlegel. 1989. Construction of lactose-utilizing strains of the poly(ß-hydroxyalkanoic acid) accumulating Alcaligenes eutrophus. In: D. Behrens and A. J. Driesel (eds.) DECHEMA-Biotechnology-Conferences, Vol. 3, Part A, pp. 421-424.
In vitro Biosynthese von PHAs
- Steinbüchel, A. 2001. Perspectives for biotechnological production and utilization of biopolymers: Metabolic engineering of polyhydroxyalkanoate biosynthesis pathways as a successful example. Macromol. Bioscience 1:1-24.
- Qi, Q., A. Steinbüchel, and B. H. A. Rehm. 2000. In vitro synthesis of poly(3-hydroxydecanoate): purification of type II polyhydroxyalkanoate synthases PhaC1 and PhaC2 from Pseudomonas aeruginosa and development of an enzyme assay. Appl. Microbiol. Biotechnol. 54:37-43.
- Liu, S.-J., and A. Steinbüchel. 2000. Exploitation of butyrate kinase and phosphotransbutyrylase from Clostridium acetobutylicum for the in vitro biosynthesis of poly(3-hydroxyalkanoic acids). Appl. Microbiol. Biotechnol. 53:545-552.
- Liu, S.-J., and A. Steinbüchel. 2000. A novel genetically engineered pathway for synthesis of poly(hydroxyalkanoic acids) in Escherichia coli. Appl. Environ. Microbiol. 66:739-743.
- Jossek, R., and A. Steinbüchel. 1998. In vitro synthesis of poly(3-hydroxybutyric acid) by using an enzymatic coenzyme A recycling system. FEMS Microbiol. Lett. 168:319-324.
- Jossek, R., Reichelt, R., and A. Steinbüchel. 1998. In vitro biosynthesis of poly(3-hydroxybutyric acid) by using purified poly(hydroxyalkanoic acid) synthase ofChromatium vinosum. Appl. Microbiol. Biotechnol. 49:258-266.
- Valentin, H. E. and A. Steinbüchel. 1994. Application of enzymatically synthesized short-chain-length hydroxy fatty acid coenzyme A thioesters for assay of polyhydroxyalkanoic acid synthases. Appl. Microbiol. Biotechnol. 40:699-709.
Biotechnologische Produktion von PHAs
Struktur und Aufbau von PHA Grana
- Ibrahim, M.H., Steinbüchel, A. (2010). High-cell-density cyclic fed-batch fermentation of a poly(3-hydroxybutyrate)-accumulating thermophile, Chelatococcus sp. strain MW10. Appl Environ Microbiol 76:7890-7895.
- Ibrahim, M.H., Willems, A., Steinbüchel, A. (2010). Isolation and characterization of new poly(3HB)-accumulating star-shaped cell-aggregates-forming thermophilic bacteria. J Appl Microbiol 109:1579-1590.
- Ibrahim, M. H. A., Steinbüchel, A. (2009). Poly(3-Hydroxybutyrate) Production from Glycerol by Zobellella denitrificans MW1 via High-Cell-Density Fed-Batch Fermentation and Simplified Solvent Extraction. Appl Environ Microbiol 75:6222-6231.
- Ibrahim, M. H. A., and A. Steinbüchel. (2009). Zobellella denitrificans strain MW1, a newly isolated bacterium suitable for poly(3-hydroxybutyratre) production from glycerol. J Appl Microbiol 108:214-225.
- Reinecke, F. & Steinbüchel, A. (2009). Ralstonia eutropha strain H16 as model organism for PHA metabolism and for biotechnological production of technically interesting biopolymers. J Mol Microbiol Biotechnol 16:91-108.
- Neumann, L., Spinozzi, F., Sinibaldi, R., Rustichelli, Pötter, M. & Steinbüchel, A. (2008). Binding of the major phasin, PhaP1, from Ralstonia eutropha H16 to Poly(3-Hydroxybutyrate) Granules. J Bacteriol 190:2911-2919.
- Kuchta, K., Chi, L., Fuchs, H., Pötter, M. & Steinbüchel, A. (2007). Studies on the influence of phasins on accumulation and degradation of PHB and Nanostructure of PHB granules in Ralstonia eutropha H16. Biomacromolecules 8:657-662.
- Pötter, M. & Steinbüchel, A. (2006). Biogenesis and structure of polyhydroxyalkanoate granules. In: Microbiology Monographs Vol. 1: Inclusions in Prokaryotes. Steinbüchel, A. (Hrsg.), Shively, J. M. (Ed.), Springer-Verlag, Berlin Heidelberg.
- Kim, D. Y., Lütke-Eversloh, T., Elbanna, K., Thakor, N. & Steinbüchel, A. (2005). Poly(3-mercaptopropionate): a nonbiodegradable biopolymer? Biomacromolecules 6:897-901.
- Pötter, M., Müller, H. & Steinbüchel, A. (2005). Influence of homologous phasins (PhaP) on PHA accumulation and regulation of their expression by the transcriptional repressor PhaR in Ralstonia eutropha H16. Microbiology 151:825-833.
- Pötter, M. & Steinbüchel, A. (2005). Poly(3-hydroxybutyrate) granule-associated proteins: impacts on poly(3-hydroxybutyrate) synthesis and degradation. Biomacromolecules 6, 552-560.
- Elbanna, K., Lütke-Eversloh, T., Jendrossek, J., Luftmann, H. & Steinbüchel, A. (2004). Studies on the biodegradability of polythioester copolymers and homopolymers by polyhydroxyalkanoate (PHA)-degrading bacteria and PHA depolymerases. Arch. Microbiol. 182:212-225.
- Pötter, M., Müller, H., Reinecke, F., Wieczorek, R., Fricke, F., Bowien, B., Friedrich, B. & Steinbüchel, A. (2004). The complex structure of polyhydroxybutyrate (PHB) granules: four orthologous and paralogous phasins occur in Ralstonia eutropha. Microbiology (SGM) 150:2301-2311.
- Pötter, M., H. Müller, and A. Steinbüchel. 2005. Influence of homologous phasins (PhaP) on PHA accumulation and regulation of their expression by the transcription repressor PhaR in Ralstonia eutropha H16. Microbiology 151:825-833.
- Pötter, M., and A. Steinbüchel. 2005. Poly(3-hydroxybutyrate) granule associated proteins: Impacts on PHB synthesis and degradation. Biomacromolecules 6:552-560.
- Zeller, M., M. Pötter, F. Reinecke, A. Steinbüchel, W. I. Burkitt, P. J. Derrick, and S. König. 2005. Mass spectrometry identifies homologues of phasin PhaP1 protein of Ralstonia eutropha on polyhydroxybutyrate granules. J. Biomacromol. Mass Spectrom. 1:75-84.
- Pötter, M., H. Müller, F. Reinecke, R. Wieczorek, F. Fricke, B. Bowien, B. Friedrich, and A. Steinbüchel. 2004. The complex structure of polyhydroxybutyrate (PHB) granules: four orthologous and paralogous phasins occur in Ralstonia eutropha. Microbiology, 150:2301-2311.
- Pötter M, M. Madkour, F. Mayer and A. Steinbüchel.2002. Regulation of phasin expression and polyhydroxyalkanoate (PHA) granule formation in Ralstonia eutropha H16. Microbiology 148:2413-26.
- Rehm, B. H. A. and A. Steinbüchel. 1999. Biochemical and genetic analysis of PHA synthases and other proteins required for PHA synthesis. Int. J. Biol. Macromol. 25:3-19.
- Föllner, C. G., M. Madkour, F. Mayer, W. Babel, and A. Steinbüchel. 1997. Analysis of the PHA granule-associated proteins GA20 and GA11 in Methylobacterium extorquens and Methylobacterium rhodesianum. J. Basic Microbiol. 37:11-21.
- Steinbüchel, A., R. Wieczorek, H. M. Alvarez and R. Jossek. 1997. Assembly of bacterial PHA granules and other aspects of PHA biosynthesis. Proceedings of the 1996 International Symposium on bacterial polyhydroxyalkanoates. G. Eggink, A. Steinbüchel, Y. Poirier and B. Witholt (Eds.) NRC Research Press, Ottawa, pp. 36-47.
- Mayer, F., M. H. Madkour, U. Pieper-Fürst, R. Wieczorek, M. Liebergesell and A. Steinbüchel. 1997. Electron microscopic observations on the macromolecular organization of the boundary layer of bacterial PHA inclusion bodies. J. Gen. Appl. Microbiol. 42:445-455.
- Liebergesell, M. and A. Steinbüchel. 1996. New knowledge about the pha-locus and PHA granule-associated proteins in Chromatium vinosum. Biotechnol. Lett. 18:719-724.
- R. Wieczorek, and A. Steinbüchel. 1996. Occurrence of PHA granule-associated proteins related to the Alcaligenes eutrophus H16 GA24-protein in other bacteria. FEMS Microbiol. Lett.135:23-30.
- Föllner, C. G., W. Babel and A. Steinbüchel. 1995. Isolation and purification of granule-associated proteins relevant for poly-3-hydroxybutyric acid (PHB) biosynthesis from methylotrophic bacteria relying on the serine pathway. Can. J. Microbiol. 41:124-130.
- Steinbüchel, A., K. Aerts, W. Babel, C. Föllner, M. Liebergesell, M. H. Madkour, F. Mayer, U. Pieper-Fürst, A. Pries, H. E. Valentin and R. Wieczorek. 1995. Considerations on the structure and biochemistry of bacterial polyhydroxyalkanoic acid inclusions. Can. J. Microbiol.41(Suppl. 1):94-105.
- Pieper-Fürst, M. H. Madkour, F. Mayer, and A. Steinbüchel (1995) Identification of the region of a 14-kDa protein of Rhodococcus ruber that is responsible for the binding of this phasin to polyhydroxyalkanoic acid granules. J. Bacteriol. 177:2513-2523.
- Wieczorek, R., A. Pries, A. Steinbüchel, and F. Mayer 1995. Analysis of a 24-kDa protein associated with the polyhydroxyalkanoic acid granules in Alcaligenes eutrophus. J. Bacteriol. 177:2425-2435.
- Steinbüchel, A. 1995. Bacterial inclusions for the synthesis of biodegradable polyesters. Polymeric Materials Science and Engineering Vol. 72, p.132 (Proceedings of the ASM Division of Polymeric Materials:Science and Engineering)
- Pieper-Fürst, U., M. H. Madkour, F. Mayer and A. Steinbüchel. 1994. Purification and characterization of a 14-kDa protein that is bound to the surface of polyhydroxyalkanoic acid granules in Rhodococcus ruber. J. Bacteriol.176:4328-4337.
- Liebergesell, M., B. Schmidt, and A. Steinbüchel. 1992. Isolation and identification of granule-associated proteins relevant for poly(3-hydroxybutyric acid) biosynthesis in Chromatium vinosum D. FEMS Microbiol. Lett. 99:227-232.
- Preusting, H., J. Kingma, G. Huisman, A. Steinbüchel, and B. Witholt. 1992. Formation of polyester blends by a recombinant strain of Pseudomonas oleovorans: different poly(3-hydroxyalkanoates) are stored in separate granules. J. Environ. Polym. Degrad. 1:45-53.
- Timm, A., D. Byrom, and A. Steinbüchel. 1990. Formation of blends of various poly(3-hydroxyalkanoic acids) by a recombinant strain of Pseudomonas oleovorans. Appl. Microbiol. Biotechnol. 33:296-301.
Regulation des PHA Stoffwechsels
- Raberg, M., Kaddor, C., Kusian, B., Stahlhut, G., Budinova, R., Kolev, N., Bowien, B., Steinbüchel, A. (2012). Impact of each individual component of the mutated PTS(Nag) on glucose uptake and phosphorylation in Ralstonia eutropha G(+)1. Appl Microbiol Biotechnol 95:735-744.
- Kaddor, C., Voigt, B., Hecker, M., Steinbüchel, A. (2012). Impact of the Core Components of the Phosphoenolpyruvate-Carbohydrate Phosphotransferase System, HPr and EI, on Differential Protein Expression in Ralstonia eutropha H16. J Proteome Res 11:3624-3636.
- Kaddor, C., Steinbüchel, A. (2011). Implications of various phosphoenolpyruvate-carbohydrate phosphotransferase system mutations on glycerol utilization and poly(3-hydroxybutyrate) accumulation in Ralstonia eutropha H16. AMB Express 1:16.
- Kaddor, C., Steinbüchel, A. (2011). Effects of homologous phosphoenolpyruvate-carbohydrate phosphotransferase system proteins on carbohydrate uptake and poly(3-Hydroxybutyrate) accumulation in Ralstonia eutropha H16. Appl Environ Microbio. 77:3582-3590.
- Raberg, M., Bechmann, J., Brandt, U., Schlüter, J., Uischner, B., Voigt, B., Hecker, M., Steinbüchel, A. (2011). Versatile metabolic adaptations of Ralstonia eutropha H16 to a loss of PdhL, the E3 component of the pyruvate dehydrogenase complex. Appl Environ Microbiol 77:2254-2263.
- Raberg, M., Peplinski, K., Heiss, S., Ehrenreich, A., Voigt, B., Döring, C., Bömeke, M., Hecker, M., Steinbüchel, A. (2011). Proteomic and transcriptomic elucidation of the mutant Ralstonia eutropha G+1 with regard to glucose utilization. Appl Environ Microbiol 77:2058-2070.
- Peplinski, K., Ehrenreich, A., Döring, C., Bömeke, M., Reinecke, F., Hutmacher, C., Steinbüchel, A. (2010). Genome-wide transcriptome analyses of the 'Knallgas' bacterium Ralstonia eutropha H16 with regard to polyhydroxyalkanoate metabolism. Microbiology 156:2136-2152.
- Raberg, M., Reinecke, F., Reichelt, R., Malkus, U., König, S., Pötter, M., Fricke, W. F., Pohlmann, A., Voigt, B., Hecker, M., Friedrich, B., Bowien, B. & Steinbüchel, A. (2008). Ralstonia eutropha H16 flagellation changes according to nutrient supply and state of poly(3-hydroxybutyrate) accumulation. Appl Environ Microbiol 74:4477-90.
- Pohlmann, A., Fricke, W. F., Reinecke, F., Kusian, B., Liesegang, H., Cramm, R., Eitinger, T., Ewering, C., Pötter, M., Schwartz, E., Strittmacher, A., Voß, I., Gottschalk, G., Steinbüchel, A., Friedrich, B. & Bowien, B. (2006). Hydrogen-based biotechnology: genome sequence of the bioplastic-producing „Knallgas“ bacterium Ralstonia eutropha H16. Nat Biotechnol 24:1257-1262.
- Pettinari, M. J., L. Chaneton, G. Vasquez, A. Steinbüchel, and B. Mendez. 2003. Insertion sequence-like elements associated with putative polyhydroxybutyrate regulatory genes in Azotobacter sp. FA8. Plasmid 50:36-44.
- Pötter, M., M. H. Madkour, F. Mayer, and A. Steinbüchel. 2002. Regulation of phasin expression and polyhydroxyalkanoate (PHA) granule formation in Ralstonia eutropha H16. Microbiology 148:2413-2426.
- Spiekermann, P., B. H. A. Rehm, R. Kalscheuer, D. Baumeister and A. Steinbüchel. 1999. A sensitive, viable colony staining method using Nile Red for direct screening of bacteria that accumulate polyhydroxyalkanoic acids and other lipid storage compounds. Arch. Microbiol.171:73-78.
- Qingsheng, Qi, A. Steinbüchel, and B. H. A. Rehm. 1998. Metabolic routing towards polyhydroxyalkanoic acid synthesis in recombinant Escherichia coli (fadR): inhibition of fatty acid ß-oxidation by acrylic acid. FEMS Microbiol. Lett. 167:89-94.
- Pettinari, M. J., G. J. Vazquez, N. Krüger, P.-S. Vary, A. Steinbüchel and B. S. Mendez.1998. Trans activation of the Escherichia coli genes for short-chain fatty acid degradation by a regulatory protein from Bacillus megaterium. Appl. Microbiol. Biotechnol. 49:737-742.
- Steinbüchel, A., R. Wieczorek, and N. Krüger. 1996. PHA biosynthesis, its regulation and application of C1-utilizing microorganisms for polyester production. In: M. E. Lidstrom and F. R. Tabita (Eds.) Microbial growth on C1 compounds, Kluwer Academic Publishers, Dordrecht, pp. 237-244.
- Floccari, M. E., N. I. Lopez, B. S. Mendez, U. Pieper-Fürst, and A. Steinbüchel. 1995. Isolation and partial characterization of Bacillus megaterium mutants deficient in poly(3-hydroxybutyrate) metabolism. Can. J. Microbiol. 41:77-79.
- Pries, A., Priefert H., N. Krüger, and A. Steinbüchel. 1991. Identification and characterization of two Alcaligenes eutrophus gene loci relevant to the phenotype poly(ß-hydroxybutyric acid)-leaky which exhibit homology to ptsH and ptsI of Escherichia coli. J. Bacteriol.173:5843-5853.
- Schubert, P., Krüger, N., and A. Steinbüchel. 1991. Molecular analysis of the Alcaligenes eutrophus poly(3-hydroxybutyrate)-, PHB-, biosynthetic operon: identification of the N-terminus of PHB-synthase and identification of the promotor. J. Bacteriol. 173:168-175.
Poly(malat)
- Rose, K., M. Liebergesell, and A. Steinbüchel. 2000. Molecular analysis of the Aureobasidium pullulans URA3 gene encoding orotidine-5´-phosphate decarboxylase and isolation of mutants defective in this gene. Appl. Microbiol. Biotechnol. 53:296-300.
- Gödde, C., M. Liebergesell, and A. Steinbüchel. 1999. Isolation of poly(ß-L-malic acid) degrading bacteria and purification and characterization of the PMA hydrolase from Comamonas acidovorans strain 7789. FEMS Microbiol. Lett. 173:365-372.
- Liu, S.-J., and A. Steinbüchel. 1997. Production of poly(malic acid) from different carbon sources and its regulation in Aureobasidium pullulans. Biotechnol. Lett. 19:11-14.
- Liu, S., and A. Steinbüchel. 1997. Production of polymalic acid by Aureobasidium pullulans CBS 591.75 and DSM 2404 in 2L and 20L fermentors. Chin. J. Biotechnol. 13:279-283.
- Liu, S., and A. Steinbüchel. 1996. Investigations of poly(ß-L-malic acid) production by strains of Aureobasidium pullulans in liquid culture. Appl. Microbiol. Biotechnol. 46:273-278.

