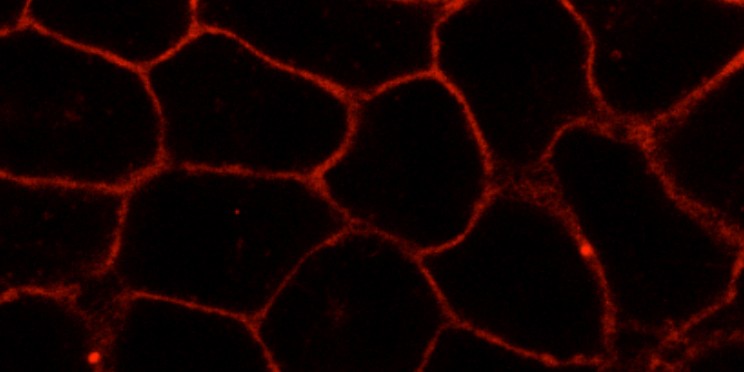
Wie Forscher die Zellmembran untersuchen
Wie funktionieren Stoffaustauschprozesse und andere Vorgänge an einer Zellmembran, der Hülle einer Körperzelle? Mechanismen von solch kleinen Dimensionen zu untersuchen, stellt Wissenschaftler vor große Herausforderungen – zum Beispiel, wenn sie herausfinden wollen, wie sich ein wichtiger Bestandteil der Membran verhält und verteilt: das Cholesterol, auch bekannt als Cholesterin. Dieser Stoff lässt sich bisher nur sehr eingeschränkt mit fluoreszierenden Farbstoffen markieren, die unter dem Mikroskop leuchten und ihn sichtbar machen – ohne dabei die Membran zu schädigen. Forscherinnen und Forscher der Universität Münster haben nun eine Methode entwickelt, mit der sie diese Schwierigkeiten umgehen können: Sie synthetisierten eine neuartige Verbindung, die dem Cholesterol ähnliche Eigenschaften besitzt, aber mit Farbstoffen markiert und in lebenden Zellen dargestellt werden kann. Dort ahmt sie das Verhalten des natürlichen Cholesterols realitätsnah nach. „Unser neuer Ansatz bietet großes Potenzial für die Bildgebung von Membrandynamiken in lebenden Zellen“, sagt Prof. Dr. Volker Gerke, einer der Studienleiter und Koordinator am Exzellenzcluster „Cells in Motion“. An der Studie arbeiteten organische Chemiker, Biochemiker und Biophysiker interdisziplinär zusammen. Sie ist aktuell in der Fachzeitschrift „Cell Chemical Biology“ erschienen.
Die Geschichte im Detail:
Wie eine schützende Hülle umgibt eine Membran eine Körperzelle und grenzt sie so von ihrer Umgebung ab. Auch in ihrem Inneren sind Zellen von Membranen durchzogen, die die einzelnen Zellbestandteile voneinander trennen und den Austausch von Stoffen zwischen den verschiedenen „Räumen“ regulieren. Dass die Membran ordentlich arbeiten kann – dafür sorgt der fettartige Stoff Cholesterol.
Synthese neuer Verbindungen
Um Stoffe herzustellen, die sich ähnlich dem natürlichen Cholesterol verhalten, synthetisierten die organischen Chemiker um Prof. Dr. Frank Glorius zunächst eine Reihe chemischer Verbindungen. Als Ausgangsstoffe verwendeten sie natürliches Cholesterol und bestimmte organische Salze, die Imidazoliumsalze. „Aus vorherigen Studien war bereits bekannt, dass diese Salze unter anderem gut mit Biomolekülen interagieren und sich daher für zelluläre Experimente eignen können“, sagt Frank Glorius, ebenfalls Studienleiter. Um die biophysikalischen Eigenschaften der neu synthetisierten Verbindungen mit denen des natürlichen Cholesterols zu vergleichen, fügten die Forscher die Stoffe in künstliche Modellmembranen aus Phospholipiden ein – Phospholipide bilden den Hauptbestandteil von Membranen. Biochemiker und Biophysiker des Exzellenzclusters in der Gruppe von Prof. Dr. Hans-Joachim Galla erfassten unter anderem, wie die neuen Substanzen die Phasenübergangstemperatur von Modellmembranen beeinflussten und wie sie den Flüssigkeitszustand der Phospholipidschicht bei verschiedenen Temperaturen veränderten. „Nach Auswertung der Daten bestimmten wir letztlich drei Verbindungen, die sehr ähnliche Eigenschaften gegenüber natürlichem Cholesterol zeigten“, sagt Lena Rakers, Doktorandin der organischen Chemie und eine Erstautorin der Studie.
Experimente in lebenden Zellen
Diese Verbindungen wählten die Wissenschaftler aus, um sie in einem nächsten Schritt in lebenden Zellmembranen und somit noch komplexeren Strukturen zu untersuchen. Hierzu verwendeten sie Kulturen von menschlichen Epithelzellen, den HeLa-Zellen, sowie menschlichen Blutgefäßzellen, den HUVEC-Zellen. Die neu synthetisierten Stoffe fügten sich aufgrund ihrer Struktur gut in die Zellmembranen ein. Mithilfe der sogenannten Oberflächen-Massenspektrometrie maßen die Wissenschaftler die Moleküle an der Membran. Die Ergebnisse zeigten: Die Verbindungen verhielten sich auch in lebenden Zellen sehr ähnlich dem natürlichen Cholesterol.
Einer der neuen Stoffe machte es aufgrund seiner Struktur möglich, ihn mit fluoreszierenden Farbstoffen zu markieren. Dazu hängten die Wissenschaftler zusätzlich eine Azidgruppe an den Stoff. An diese Azidgruppe koppelten sie die Farbstoffe mithilfe der Klick-Chemie – ein effektives Verfahren, mit dem sich auf Grundlage weniger chemischer Reaktionen molekulare Bausteine miteinander verbinden lassen. Anschließend machten die Biochemiker den Stoff mithilfe hochauflösender Konfokalmikroskopie in den lebenden Zellen sichtbar und konnten so seine Verteilung und dynamischen Veränderungen beobachten. „Auch diese Analysen zeigten, dass die neuartige Verbindung sich analog dem zellulären Cholesterol verhielt“, sagt David Grill, Doktorand der medizinischen Biochemie und ebenfalls federführender Autor der Studie. Ein großer Pluspunkt der neuen Methode: Während des gesamten Verfahrens blieb die Zellmembran in ihren Bestandteilen und Eigenschaften unbeschädigt.
In der Zukunft wollen die Forscher ihre Methode weiterentwickeln und sie in weiteren zellulären Studien mit verschiedenen mikroskopischen Bildgebungsverfahren testen. Ein Ziel ist es, nicht nur fluoreszierende Farbstoffe, sondern auch andere Moleküle mit der Klick-Chemie an die neue Verbindung zu hängen, um weitere Messungen, aber auch selektive Veränderungen der Membran durchführen zu können.
Förderung
Die Studie erhielt finanzielle Unterstützung durch den Exzellenzcluster „Cells in Motion“ der Universität Münster (WWU), den von der Deutschen Forschungsgemeinschaft (DFG) geförderten Sonderforschungsbereich 858 „Synergistic Effects in Chemistry – From Additivity towards Cooperativity“ der WWU sowie eine Einzelförderung der DFG.
Originalpublikation:
Rakers L#, Grill D#, Matos A, Wulff S, Wang D, Börgel J, Körsgen M, Arlinghaus HF, Galla HJ*, Gerke V*, Glorius F* (2018): Addressable Cholesterol Analogs for Live Imaging of Cellular Membranes Cell Chem Biol; DOI: 10.2016/j.chembiol.2018.04.015.
#equal contribution
*Corresponding authors
