Krisenhilfe für gestresste Zellen
Mitochondrien bieten einem Forschungsteam der Westfälischen Wilhelms-Universität (WWU) Münster zufolge unerwartete Krisenhilfe für Zellen, indem sie schädliche Stoffe „veratmen“. Eine aktuelle Studie aus dem Institut für Biologie und Biotechnologie der Pflanzen (IBBP) zeigt dreierlei: dass dieser Mechanismus durch reduktiven Stress ausgelöst werden kann, dass er die Faltung von für den Export bestimmten Proteinen beschützt und dass die „Zellkraftwerke“ somit noch flexibler agieren als bisher bekannt. Die Studie ist nun im Fachjournal „The Plant Cell“ erschienen.
„,Hauptberuflich‘ sind Mitochondrien die Knotenpunkte des Stoffwechsels und der Energieumwandlung“, erläutert Prof. Dr. Markus Schwarzländer vom IBBP. „Überraschend ist, dass sie offenbar auch überschüssige Verbindungen, sogenannte Thiole, unschädlich machen können, die ansonsten an anderen Orten der Zelle zu Schäden führen könnten.“ Dazu werde ein besonderes Krisenprogramm ausgelöst, der ‚ANAC017 Signalweg‘. Das Protein ‚Alternative Oxidase‘ sorge für eine höhere Atmungskapazität der Mitochondrien in Pflanzen. Dieser Vorgang war vor einigen Jahren von einer australischen und einer belgischen Arbeitsgruppe entdeckt worden. Neu ist die Erkenntnis, dass er durch reduktiven Stress ausgelöst werden und dem Schutz der Proteinfaltung im Endoplasmatischen Retikulum (ER) dienen kann – also dem Exportsystem für Proteine in der Zelle. Ebenfalls neu und unerwartet ist laut der aktuellen Studie, dass es den Mitochondrien gelingt, Thiole mit hoher Rate zu veratmen. „Das widerspricht der gängigen Lehrmeinung“, räumt Markus Schwarzländer ein. „Deshalb haben wir unterschiedliche Methoden eingesetzt, um die Beobachtungen unabhängig zu validieren und mögliche Fehler auszuschließen.“

Hintergrund:
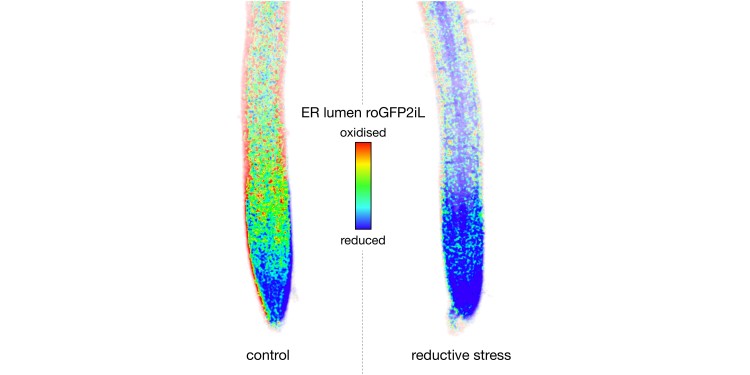
Alles Leben besteht aus Zellen. Alle Zellen benötigen Proteine, die sehr präzise gefaltet werden müssen, damit sie ihre Funktion erfüllen können. Die Proteine, die von Tieren, Pilzen und Pflanzen sekretiert, also aus der Zelle herausgeschleust werden, oder an ihrer Oberfläche zur Umweltinteraktion beitragen, müssen dabei mithilfe sogenannter Disulfidbrücken stabilisiert werden. Ein Beispiel beim Menschen ist das bekannte Insulin. Generell funktionieren aber unzählige lebenswichtige Rezeptor- und Signalproteine nur mit korrekten Verknüpfungen über Disulfidbrücken. Diese werden in einem ganz bestimmten Ort der Zelle, dem sogenannten Endoplasmatischen Retikulum (ER) geknüpft. Dazu werden Schwefelatome von je zwei Thiolgruppen der Aminosäure Cystein im Inneren des ER oxidiert und kovalent miteinander verbunden.
Steigt aber der Bedarf an Disulfidbrücken plötzlich an oder werden sie durch einen Stressfaktor oder bestimmte chemische Substanzen aufgebrochen, ist das für die Zelle problematisch. Falsch gefaltete Proteine können großen Schaden verursachen – bis hin zum Tod. Daher reagiert die Zelle mit speziellen Krisenprogrammen. Diese gut untersuchten Programme unterstützen die Proteinfaltung im Inneren des ER, indem sie etwa für zusätzliche Kapazität in der Oxidationsmaschinerie sorgen. Im Krisenfall bekommt das ER überraschend Unterstützung aus einem anderen Bereich der Zelle.
Methodisches Vorgehen
Die vorliegende Studie basiert in entscheidenden Teilen auf der „In vivo Biosensorik“. Der innovative Einsatz der optogenetischen Biosensorik ist eine Kernexpertise der Arbeitsgruppe des IBBP Münster. Synthetische Proteine dienen dabei als künstliche Messsensoren. Sie werden genetisch codiert, so dass es die Pflanzen selbst sind, die die Sensoren herstellen. In der lebenden Pflanzenzelle geben sie live Auskunft über den jeweiligen Stoffwechselzustand. Solche Sensoren können zur Messung in einzelne Teilbereiche der Zelle verbracht werden, die Organisation innerhalb der Zelle bleibt also erhalten. Für die quantitative Mikroskopie nutzten die Wissenschaftler ein hochauflösendes Konfokalmikroskop. Alle Arbeiten wurden an den Universitäten Münster und Bonn durchgeführt.
Förderung
Die Studie wurde von der Deutschen Forschungsgemeinschaft (DFG) gefördert.
Originalpublikation
Fuchs P, Bohle F, Lichtenauer S, Ugalde JM, Feitosa Araujo E, Mansuroglu B, Ruberti C, Wagner S, Müller-Schüssele SJ, Meyer AJ, Schwarzländer M (2022) Reductive stress triggers NAC17-mediated retrograde signaling to safeguard the ER by boosting mitochondrial respiratory capacity. Plant Cell.
DOI: 10.1093/plcell/koac017
