
Palladium-Katalyse mit Licht aktivieren: Wie man einem Übergangsmetall neue Tricks beibringt
Bei der Herstellung von Verbindungen haben Chemikerinnen und Chemiker das grundlegende Ziel, möglichst viele der eingesetzten Substanzen zu nutzen und Abfallprodukte zu vermeiden. Durchbrüche bei der Suche nach solchen Strategien dienen unter anderem dazu, industrielle Innovationen voranzutreiben und Medikamente zu entwickeln. In diesem Zusammenhang haben sogenannte allylische Substitutionsreaktionen durch Katalysatoren aus Übergangsmetallen bereits zu bedeutenden Fortschritten in der Wissenschaft geführt. Dabei bewirken die Katalysatoren, dass in einem Molekül ein Austausch einer Gruppe in allylischer Position, also in direkter Nähe zu einer Kohlenstoff-Kohlenstoff-Doppelbindung, stattfindet.
Insbesondere die sogenannte Allylfunktionalisierung durch einen Katalysator, der auf dem Übergangsmetall Palladium basiert, ist seit einigen Jahrzehnten zu einer gut etablierten Methode geworden, um Kohlenstoff-Kohlenstoff- oder Kohlenstoff-Heteroatom-Bindungen aufzubauen, die für die Herstellung von Naturstoffen und Arzneimitteln sowie die Materialwissenschaft nützlich sind. Dennoch bestehen in der Praxis noch immer erhebliche Herausforderungen, vor allem hinsichtlich der Nachhaltigkeit der Stoffe und ihrer Fähigkeit, chemische Reaktionen einzugehen.
Ein Forscherteam unter der Leitung von Prof. Dr. Frank Glorius von der Westfälischen Wilhelms-Universität Münster (WWU) hat jetzt einen neuen Ansatz zur Allylfunktionalisierung entwickelt und mithilfe der sogenannten Radikalchemie π-Allylpalladium-Komplexe hergestellt. Die Studie ist in der Fachzeitschrift „Nature Catalysis“ erschienen.
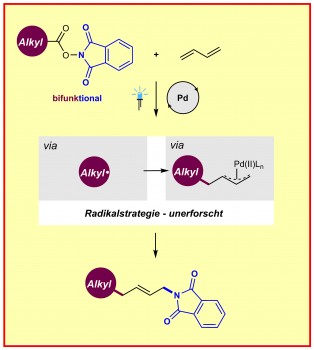
Die neue Methode funktioniert so: Ein kommerziell erhältlicher Palladium-Katalysator wird durch sichtbares Licht angeregt, woraufhin N-Hydroxyphthalimid-Ester, die von preiswerten und reichlich vorhandenen aliphatischen Carbonsäuren abgeleitet werden, mit Dienen verschmelzen – organisch-chemischen Verbindungen, die zwei Kohlenstoff-Kohlenstoff-Doppelbindungen enthalten. Das hat zur Folge, dass π-Allylpalladium-Komplexe effizient erzeugt werden können. Es kommt zu einer sogenannten 1,4-Aminoalkylierung der Diene, was die Wissenschaftler an mehr als 60 Beispielen demonstrierten. Darüber hinaus konnten sie in ihrer Studie zeigen, dass ihre Strategie auch bei radikalischen Kaskadenreaktionen und bei der Modifizierung von Medikamenten und Naturstoffen angewendet werden kann.
„Dies ist eine Innovation in der Palladiumchemie. Wir haben diesem alten Übergangsmetall-Katalysator neue Tricks beigebracht. Zusätzlich wurden leicht verfügbare N-Hydroxyphthalimid-Ester als bifunktionelle Reagenzien eingesetzt, wodurch wir zwei Fliegen mit einer Klappe geschlagen haben“, sagt Dr. Huan-Ming Huang, Erstautor der Studie.
Förderung:
Die Studie erhielt finanzielle Unterstützung von der Alexander von Humboldt-Stiftung, der Europäischen Union über den „Marie Skłodowska Curie Grant“ und der Deutschen Forschungsgemeinschaft über den Sonderforschungsbereich SFB 858 und den Leibniz-Preis.
Originalpublikation:
H.-M. Huang et al. (2020): Catalytic radical generation of π-allylpalladium complexes. Nature Catalysis; DOI: 10.1038/s41929-020-0434-0
