cURRICULUM VITAE
| seit 2024 |
Forschungsaufenthalt am Institut für Molekularbiologie und Genetik, Universität Aarhus, Dänemark. |
| seit 2021 |
Nachwuchsgruppenleiter am Institut für Pharmazeutische und Medizinische Chemie sowie am Institut für Genetik von Herzerkrankungen, Abteilung Zelluläre Elektrophysiologie und Molekularbiologie |
| 2019 - 2021 |
Postdoktorand am Institut für Genetik von Herzerkrankungen, Abteilung Zelluläre Elektrophysiologie und Molekularbiologie, Universitätsklinikum Münster und am Institut für Pharmazeutische und Medizinische Chemie, Universität Münster. |
| 2015 - 2019 |
Doktorand am Institut für Pharmazeutische und Medizinische Chemie, Universität Münster. |
| 2015 | Approbation als Apotheker |
| 2010 - 2014 | Studium der Pharmazie, Universität Münster |
Preise und Förderprogramme
| 2024 |
DAAD PRIME Förderung |
| 2021 |
Innovative Medizinische Forschung (IMF) Münster |
| 2020 |
PHOENIX Wissenschaftspreis |
| 2016 |
Cells in Motion Pilot Project PP-2016-23 |
Forschungsschwerpunkt: Molekulare Pharmakologie von Ionenkanälen
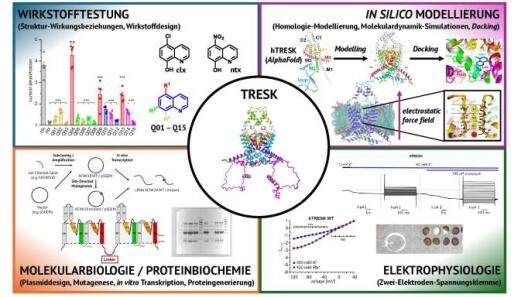
Ionenkanäle sind Membranproteine, die an zahlreichen physiologischen Prozessen beteiligt sind. Mehr als 300 verschiedene Ionenkanäle sind im menschlichen Körper bekannt, die sich aufgrund ihrer Leitfähigkeit (K+, Na+, Ca2+, Cl-, etc.) oder ihres Öffnungsmechanismus (spannungsgesteuert, ligandengesteuert, temperatur- und mechanosensitiv) einteilen lassen. Die größte Superfamilie stellt dabei die Familie der K+-Kanäle dar, die sich wiederum in spannungsgesteuerte (Kv), einwärts rektifizierende (Kir), Ca2+ und Na+ gesteuerte (KCa / KNa) sowie Zwei-Porendomänen (K2P) K+-Kanäle unterscheiden lassen. Zu den K2P-Kanälen zählen auch die Kanäle TREK1 (K2P2.1), TREK2 (K2P10.1) und TRESK (K2P18.1), die sich aufgrund ihrer zentralen Funktionen in neuronalen Geweben sowie immunassoziierten Zellen als vielversprechende Targets für die Entwicklung neuer Arzneistoffkandidaten anbieten. Durch Kombination verschiedenster in vitro und in silico Techniken (siehe Abbildung) versuchen wir die Modulation von Ionenkanälen durch Testverbindungen auf molekularer Ebene zu verstehen und somit die Funktionsweise der Ionenkanäle, die durch Konformationsänderungen beeinflusst wird, im Detail zu verstehen. Dieses Verständnis molekularer Interaktionen zwischen Verbindungen und Ionenkanälen kann zur gezielten Entwicklung neuer Ionenkanalmodulatoren beitragen. Neben der Entwicklung neuer Verbindungen können die von uns genutzten Techniken aber auch die Beeinflussung der molekularen Ionenkanalfunktion durch patientenbezogene Mutationen aufklären und damit ein tieferes Verständnis pathophysiologischer Prozesse generieren.
Publikationsliste
Originalarbeiten
- Dombovski, A., Steigerwald, R., Ritter, N., Disse, P., Goerges, G., Osthues, J., Aymanns, I., Dilkaute, C., Schreiber, J., Düfer, M., Seebohm, G., Wünsch, B., & Jose, J. A novel fluorescent labeling compound for GluN2A containing N-methyl-D-aspartate receptors identified by Autodisplay-based screening. J Pharm Anal, in Press, https://doi.org/10.1016/j.jpha.2024.01.013.
- Korff, M., Lüken, J., Schmidt, J., Schepmann, D., Goerges, G., Ritter, N., Disse, P., Schreiber, J. A., Seebohm, G., & Wünsch, B. (2023). Negative allosteric modulators of NMDA receptors with GluN2B subunit: synthesis of β-aminoalcohols by epoxide opening and subsequent rearrangement. Org Biomol Chem, 21(37), 7616–7638. https://doi.org/10.1039/d3ob01208e.
- Lüken, J., Goerges, G., Ritter, N., Disse, P., Schreiber, J. A., Schmidt, J., Frehland, B., Schepmann, D., Seebohm, G., & Wünsch, B. (2023). Indazole as a Phenol Bioisostere: Structure-Affinity Relationships of GluN2B-Selective NMDA Receptor Antagonists. J Med Chem, 66(16), 11573–11588. https://doi.org/10.1021/acs.jmedchem.3c01161.
- Ritter, N., Disse, P., Aymanns, I., Mücher, L., Schreiber, J. A., Brenker, C., Strünker, T., Schepmann, D., Budde, T., Strutz-Seebohm, N., Ametamey, S. M., Wünsch, B., & Seebohm, G. (2023). Downstream Allosteric Modulation of NMDA Receptors by 3-Benzazepine Derivatives. Mol Neurobiol, 60(12), 7238–7252. https://doi.org/10.1007/s12035-023-03526-1.
- Schreiber, J. A., Derksen, A., Goerges, G., Schütte, S., Sörgel, J., Kiper, A. K., Strutz-Seebohm, N., Ruck, T., Meuth, S. G., Decher, N., & Seebohm, G. (2023). Cloxyquin activates hTRESK by allosteric modulation of the selectivity filter. Commun Biol, 6(1), 745. https://doi.org/10.1038/s42003-023-05114-4.
- Dellin, M., Rohrbeck, I., Asrani, P., Schreiber, J. A., Ritter, N., Glorius, F., Wünsch, B., Budde, T., Temme, L., Strünker, T., Stallmeyer, B., Tüttelmann, F., Meuth, S. G., Spehr, M., Matschke, J., Steinbicker, A., Gatsogiannis, C., Stoll, R., Strutz-Seebohm, N., & Seebohm, G. (2023). The second PI(3,5)P2 binding site in the S0 helix of KCNQ1 stabilizes PIP2-at the primary PI1 site with potential consequences on intermediate-to-open state transition. Biol Chem, 404(4), 241–254. https://doi.org/10.1515/hsz-2022-0247.
- Günl, F., Krischuns, T., Schreiber, J. A., Henschel, L., Wahrenburg, M., Drexler, H. C. A., Leidel, S. A., Cojocaru, V., Seebohm, G., Mellmann, A., Schwemmle, M., Ludwig, S., & Brunotte, L. (2023). The ubiquitination landscape of the influenza A virus polymerase. Nat Commun, 14(1), 787. https://doi.org/10.1038/s41467-023-36389-0.
- Markus, A., Schreiber, J. A., Goerges, G., Frehland, B., Schepmann, D., Daniliuc, C., Fröhlich, R., Seebohm, G., & Wünsch, B. (2022). Phenol-benzoxazolone bioisosteres of GluN2B-NMDA receptor antagonists: Unexpected rearrangement during reductive alkylation with phenylcyclohexanone. Arch Pharm (Weinheim), 355(11), e2200225. https://doi.org/10.1002/ardp.202200225.
- Oniani, T., Vinnenberg, L., Chaudhary, R., Schreiber, J. A., Riske, K., Williams, B., Pape, H. C., White, J. A., Junker, A., Seebohm, G., Meuth, S. G., Hundehege, P., Budde, T., & Zobeiri, M. (2022). Effects of Axonal Demyelination, Inflammatory Cytokines and Divalent Cation Chelators on Thalamic HCN Channels and Oscillatory Bursting. Int J Mol Sci, 23(11), 6285. https://doi.org/10.3390/ijms23116285.
- Markus, A., Schreiber, J. A., Goerges, G., Frehland, B., Seebohm, G., Schepmann, D., & Wünsch, B. (2022). Phenol-Benzoxazolone bioisosteres: Synthesis and biological evaluation of tricyclic GluN2B-selective N-methyl- d-aspartate receptor antagonists. Arch Pharm (Weinheim), 355(9), e2200147. https://doi.org/10.1002/ardp.202200147.
- Bechthold, E., Schreiber, J. A., Ritter, N., Schepmann, D., Daniliuc, C., Seebohm, G., & Wünsch, B. (2022). Synthesis and biological evaluation of conformationally restricted GluN2B ligands derived from eliprodil. Eur J Med Chem, 237, 114359. https://doi.org/10.1016/j.ejmech.2022.114359.
- Schreiber, J. A., Möller, M., Zaydman, M., Zhao, L., Beller, Z., Becker, S., Ritter, N., Hou, P., Shi, J., Silva, J., Wrobel, E., Strutz-Seebohm, N., Decher, N., Schmitt, N., Meuth, S. G., Düfer, M., Wünsch, B., Cui, J., & Seebohm, G. (2022). A benzodiazepine activator locks Kv7.1 channels open by electro-mechanical uncoupling. Commun Biol, 5(1), 301. https://doi.org/10.1038/s42003-022-03229-8.
- Bechthold, E., Schreiber, J. A., Ritter, N., Grey, L., Schepmann, D., Daniliuc, C., González-Cano, R., Nieto, F. R., Seebohm, G., & Wünsch, B. (2022). Synthesis of tropane-based σ1 receptor antagonists with antiallodynic activity. Eur J Med Chem, 230, 114113. https://doi.org/10.1016/j.ejmech.2022.114113.
- Ruck, T., Bock, S., Pfeuffer, S., Schroeter, C. B., Cengiz, D., Marciniak, P., Lindner, M., Herrmann, A., Liebmann, M., Kovac, S., Gola, L., Rolfes, L., Pawlitzki, M., Opel, N., Hahn, T., Dannlowski, U., Pap, T., Luessi, F., Schreiber, J. A., Wünsch, B., Kuhlmann, T., Seebohm, G., Tackenberg, B., Seja, P., Döring, F., Wischmeyer, E., Chasan, A. I., Roth, J., Klotz, L., Meyer zu Hörste, G., Wiendl, H., Marschall, T., Floess, S., Huehn, J., Budde, T., Bopp, T., Bittner, S., & Meuth, S. G. (2022). K2P18.1 translates T cell receptor signals into thymic regulatory T cell development. Cell Res, 32(1), 72–88. https://doi.org/10.1038/s41422-021-00580-z.
- Rajan, R., Schepmann, D., Steigerwald, R., Schreiber, J. A., El-Awaad, E., Jose, J., Seebohm, G., & Wünsch, B. (2021). [2.2]Paracyclophane-Based TCN-201 Analogs as GluN2A-Selective NMDA Receptor Antagonists. ChemMedChem, 16(20), 3201–3209. https://doi.org/10.1002/cmdc.202100400.
- Jeworutzki, E., Tüttelmann, F., Rothenberg, I., Pusch, M., Schreiber, J. A., Kliesch, S., Wünsch, B., Strutz-Seebohm, N., & Seebohm, G. (2021). Can Unlikely Neanderthal Chloride Channel CLC-2 Gene Variants Provide Insights in Modern Human Infertility?. Cell Physiol Biochem, 55(3), 301–310. https://doi.org/10.33594/000000376.
- Ritter, N., Korff, M., Markus, A., Schepmann, D., Seebohm, G., Schreiber, J. A., & Wünsch, B. (2021). Deconstruction - Reconstruction: Analysis of the Crucial Structural Elements of GluN2B-Selective, Negative Allosteric NMDA Receptor Modulators with 3-Benzazepine Scaffold. Cell Physiol Biochem, 55(S3), 1–13. https://doi.org/10.33594/000000335.
- Bechthold, E., Schreiber, J. A., Lehmkuhl, K., Frehland, B., Schepmann, D., Bernal, F. A., Daniliuc, C., Álvarez, I., Garcia, C. V., Schmidt, T. J., Seebohm, G., & Wünsch, B. (2021). Ifenprodil Stereoisomers: Synthesis, Absolute Configuration, and Correlation with Biological Activity. J Med Chem, 64(2), 1170–1179. https://doi.org/10.1021/acs.jmedchem.0c01912.
- Rajan, R., Schepmann, D., Schreiber, J. A., Seebohm, G., & Wünsch, B. (2021). Synthesis of GluN2A-selective NMDA receptor antagonists with an electron-rich aromatic B-ring. Eur J Med Chem, 209, 112939. https://doi.org/10.1016/j.ejmech.2020.112939.
- Lübke, M., Schreiber, J. A., Le Quoc, T., Körber, F., Müller, J., Sivanathan, S., Matschke, V., Schubert, J., Strutz-Seebohm, N., Seebohm, G., & Scherkenbeck, J. (2020). Rottlerin: Structure Modifications and KCNQ1/KCNE1 Ion Channel Activity. ChemMedChem, 15(12), 1078–1088. https://doi.org/10.1002/cmdc.202000083.
- Bollmann, E., Schreiber, J. A., Ritter, N., Peischard, S., Ho, H. T., Wünsch, B., Strünker, T., Meuth, S., Budde, T., Strutz-Seebohm, N., & Seebohm, G. (2020). 4,4'-Diisothiocyanato-2,2'-Stilbenedisulfonic Acid (DIDS) Modulates the Activity of KCNQ1/KCNE1 Channels by an Interaction with the Central Pore Region. Cell Physiol Biochem, 54(2), 321–332. https://doi.org/10.33594/000000222.
- Temme, L., Bechthold, E., Schreiber, J. A., Gawaskar, S., Schepmann, D., Robaa, D., Sippl, W., Seebohm, G., & Wünsch, B. (2020). Negative allosteric modulators of the GluN2B NMDA receptor with phenylethylamine structure embedded in ring-expanded and ring-contracted scaffolds. Eur J Med Chem, 190, 112138. https://doi.org/10.1016/j.ejmech.2020.112138.
- Schreiber, J. A., Schepmann, D., Frehland, B., Thum, S., Datunashvili, M., Budde, T., Hollmann, M., Strutz-Seebohm, N., Wünsch, B., & Seebohm, G. (2019). A common mechanism allows selective targeting of GluN2B subunit-containing N-methyl-D-aspartate receptors. Commun Biol, 2, 420. https://doi.org/10.1038/s42003-019-0645-6.
- Amedonu, E., Brenker, C., Barman, S., Schreiber, J. A., Becker, S., Peischard, S., Strutz-Seebohm, N., Strippel, C., Dik, A., Hartung, H. P., Budde, T., Wiendl, H., Strünker, T., Wünsch, B., Goebels, N., Meuth, S. G., Seebohm, G., & Melzer, N. (2019). An Assay to Determine Mechanisms of Rapid Autoantibody-Induced Neurotransmitter Receptor Endocytosis and Vesicular Trafficking in Autoimmune Encephalitis. Front Neurol, 10, 178. https://doi.org/10.3389/fneur.2019.00178.
- Schreiber, J. A., Müller, S. L., Westphälinger, S. E., Schepmann, D., Strutz-Seebohm, N., Seebohm, G., & Wünsch, B. (2018). Systematic variation of the benzoylhydrazine moiety of the GluN2A selective NMDA receptor antagonist TCN-201. Eur J Med Chem, 158, 259–269. https://doi.org/10.1016/j.ejmech.2018.09.006.
- Börgel, F., Szermerski, M., Schreiber, J. A., Temme, L., Strutz-Seebohm, N., Lehmkuhl, K., Schepmann, D., Ametamey, S. M., Seebohm, G., Schmidt, T. J., & Wünsch, B. (2018). Synthesis and Pharmacological Evaluation of Enantiomerically Pure GluN2B Selective NMDA Receptor Antagonists. ChemMedChem, 13(15), 1580–1587. https://doi.org/10.1002/cmdc.201800214.
- Temme, L., Schepmann, D., Schreiber, J. A., Frehland, B., & Wünsch, B. (2018). Comparative Pharmacological Study of Common NMDA Receptor Open Channel Blockers Regarding Their Affinity and Functional Activity toward GluN2A and GluN2B NMDA Receptors. ChemMedChem, 13(5), 446–452. https://doi.org/10.1002/cmdc.201700810.
- Gawaskar, S., Temme, L., Schreiber, J. A., Schepmann, D., Bonifazi, A., Robaa, D., Sippl, W., Strutz-Seebohm, N., Seebohm, G., & Wünsch, B. (2017). Design, Synthesis, Pharmacological Evaluation and Docking Studies of GluN2B-Selective NMDA Receptor Antagonists with a Benzo[7]annulen-7-amine Scaffold. ChemMedChem, 12(15), 1212–1222. https://doi.org/10.1002/cmdc.201700311.
- Dey, S., Temme, L., Schreiber, J. A., Schepmann, D., Frehland, B., Lehmkuhl, K., Strutz-Seebohm, N., Seebohm, G., & Wünsch, B. (2017). Deconstruction - reconstruction approach to analyze the essential structural elements of tetrahydro-3-benzazepine-based antagonists of GluN2B subunit containing NMDA receptors. Eur J Med Chem, 138, 552–564. https://doi.org/10.1016/j.ejmech.2017.06.068.
- Müller, S. L., Schreiber, J. A., Schepmann, D., Strutz-Seebohm, N., Seebohm, G., & Wünsch, B. (2017). Systematic variation of the benzenesulfonamide part of the GluN2A selective NMDA receptor antagonist TCN-201. Eur J Med Chem, 129, 124–134. https://doi.org/10.1016/j.ejmech.2017.02.018.
Übersichtsarbeiten
- Schreiber, J. A., Düfer, M., & Seebohm, G. (2022). The Special One: Architecture, Physiology and Pharmacology of the TRESK Channel. Cell Physiol Biochem, 56(6), 663–684. https://doi.org/10.33594/000000589.
- Korff, M., Steigerwald, R., Bechthold, E., Schepmann, D., Schreiber, J. A., Meuth, S. G., Seebohm, G., & Wünsch, B. (2022). Chemical, pharmacodynamic and pharmacokinetic characterization of the GluN2B receptor antagonist 3-(4-phenylbutyl)-2,3,4,5-tetrahydro-1H-3-benzazepine-1,7-diol - starting point for PET tracer development. Biol Chem, 10.1515/hsz-2022-0222. https://doi.org/10.1515/hsz-2022-0222.
- Seebohm, G., & Schreiber, J. A. (2021). Beyond Hot and Spicy: TRPV Channels and their Pharmacological Modulation. Cell Physiol Biochem, 55(S3), 108–130. https://doi.org/10.33594/000000358.
Buchbeiträge
- Schreiber, J. A., & Seebohm, G. (2021). Cardiac K+ Channels and Channelopathies. Handb Exp Pharmacol, 267, 113–138. https://doi.org/10.1007/164_2021_513.



